Индикаторный подход к оценке состояния природных систем обусловливает применение репрезентативных критериев для оценки состояния и нормирования воздействий на естественные и антропогенно-трансформированные наземные и водные эко- и геосистемы. Такие критерии часто называют индикаторами, индексами состояния системы и ее эмерджентных свойств, маркерами системы, трассерами траекторий развития.
Одним из основных индикаторов состояния и трансформации природных экосистем традиционно выступает соотношение скоростей процессов продуцирования и деструкции органического вещества в системе. Например, кризисное состояние природной системы связывают с утратой ее способности продуцировать органическое вещество в экосистеме, а «злокачественное увеличение продуктивности» обусловливает антропогенное эвтрофирование водных экосистем [1]. Отношение «продукция / деструкция» показывает, какие процессы в данный момент преобладают в экосистеме: новообразование и биосинтез нового органического вещества или разрушение и разложение мортмассы, деструкция и минерализация взвешенного и растворенного органического вещества. При этом, как правило, в практике оценивания рассматривается отношение валовой первичной продукции к суммарной деструкции органического вещества на временном интервале функционирования экосистемы. Деструкция и минерализация органического вещества осуществляются в водной экосистеме организмами-деструкторами (свободноплавающими и агрегированными с детритом бактериями), а также другими гидробионтами (фито-, зоопланктон, бентос, рыбы и др.) в процессе их трат на обмен (единый дыхательно-выделительный процесс, присущий всем живым организмам), а первичная продукция создается первичными продуцентами (фитопланктон, макрофиты, фитобентос). В последние годы появились новые обобщения и модельные представления, описывающие эти и другие процессы в водной среде и оценку факторов, их обусловливающих [2, 3]. Реже разрабатывались модели факториальной экологии, описывающие влияние какого-либо одного или нескольких факторов на указанные процессы. Параллельно решались проблемы совместного учета факторов по типу (Л-моделей или М-моделей), совершенствовался мониторинг, разрабатывались модели функционирования водных экосистем в целом [4–6].
На основе обобщения результатов мониторинговых наблюдений за межгодовой изменчивостью D/P-отношений в летнее время и моделирования мелководной экосистемы оценить влияние факторов среды и биоты на внутригодовое изменение D/P.
Материалы и методы исследования
Модели P/D или D/P-отношений применяются в процессе анализа результатов моделирования экосистемы в целом, и это оправдано, поскольку и числитель, и знаменатель этих отношений являются функциями многих факторов, их учет сопоставим с созданием отдельных блоков имитационной модели водной экосистемы в целом. Первый вариант (P/D) чаще присутствует в биологических или экосистемных исследованиях, выполненных с позиций био- или экоцентризма. В водоеме это отношение изменяется в течение суток, по глубине и по сезонам года. Второй вариант (D/P) чаще встречается в системном моделировании, поскольку дает возможность оценить вклад различных гидробионтов в суммарную деструкцию и способность системы к самоочищению. В целом D/P является одним из важнейших индикаторов «устойчивого развития» водных экосистем. Его незначительное изменение при внешнем воздействии на экосистему свидетельствует об устойчивости экосистемы к оказанному воздействию. Его направленное изменение в сторону снижения D/P иллюстрирует результат естественного или антропогенного эвтрофирования водной экосистемы. При этом на моделях может быть определена антропогенная составляющая этих изменений на фоне естественного изменения продукционно-деструкционных отношений в экосистеме.
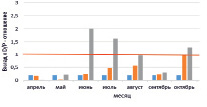
1. Наблюдения за первичной продукцией и деструкцией органического вещества в водной экосистеме. Наблюдения осуществлялись в летнее время (июль) на малом озере Суури (Большое Волковское) в северо-западном Приладожье методом светлых и темных склянок [5, 7]. Ниже приводится обсуждение результатов исследований 2016–2018 гг. Значения D:Pвал в открытом районе озера, в большинстве случаев оказались > 1,0. Это свидетельствует о том, что в это время процессы деструкции органического вещества превышали его новообразование.
В 2016 г. исследования в центральном районе оз. Суури проводились пять раз [3, 5]. Средняя глубина прозрачности в период суточной станции составила 1,57 м. Среднее значение Рвал = 0,55 мг О2/л*сут; D = 1,13 мг О2/л*сут; D/Pвал = 2,36. Отношение D:Pвал для верхнего горизонта наблюдений составило 2,05. Сравнение данных 2016 и 2015 гг. позволило сделать вывод о том, что увеличение примерно на 0,5 м уровня воды в озере в 2016 г. уменьшило продукционную способность озерной экосистемы в период наблюдений примерно в 1,5–2 раза. Подтвердился вывод о том, что повышение уровня воды в водоеме является значимым фактором в борьбе с его эвтрофированием. Деструкция органического вещества в озере снизилась в 1,1–1,3 раза, что указывает на разные темпы продукции и деструкции органического вещества [7].
В 2017 г. наблюдения выполнялись на шести станциях [7]. Среднее значение Рвал составило 0,83 мг О2/л сут, при разбросе данных от 0,4 до 1,2 мг О2/л сут. Среднее значение D = 1,73 мг О2/л сут при разбросе данных от 0,8 до 2,6 мг О2/л сут. В целом деструкция превышала образование нового органического вещества в период работ в 2,37 раза. Получено, что в 2017 г. в слое средней прозрачности воды за 1 сутки образовалось 149 кг С сут-1. В этом же слое подверглось деструкции 311 кг С сут1.
Исследования 2018 г. показали, что средняя глубина прозрачности в период исследований составила 1,48 м. Среднее значение Рвал = 0,38 мг О2/л*сут; D = 1,41 мг О2/л*сут; D/Pвал = 4,02. Полученные значения D/Pвал подтвердили вывод о том, что исследуемый водоем способен к самоочищению и справляется с нагрузками на него. Расчет количества органического вещества, образовавшегося за одни сутки (с 10 по 15.07.18) в слое средней прозрачности воды показал, что по величине валовой продукции фитопланктоном было синтезировано 66,53 кг С сут-1. Также было показано, что за одни сутки в оз. Суури подверглось деструкции 241,27 кг С сут-1. Параллельно с основными наблюдениями был проведен эксперимент для исследования влияния объема склянок на результаты экспериментов. По сравнению с традиционным (0,25 л) объем был увеличен до 2 л. Это позволило оценить чистую планктонную продукцию в озере, которая составила 0,64 мг О2/л*сут.
2. Моделирование D/Pвал – отношений. Первичную продукцию и деструкцию оценим на основе следующих модельных расчетов [5]. Для упрощения задачи будем считать, что основными гидробионтами в водоеме являются: фитопланктон (F), зоо- планктон (Z), бактерии (B), ассоциированные с детритом (Д). Найдем валовую первичную продукцию:
Рвал = (μF + rF)F, (1)
где μF – интенсивность чистого первичного биосинтеза фитопланктона, rF – интенсивность трат на обмен фитопланктона, F – биомасса фитопланктона.
Деструкцию (D) органического вещества в воде представим как
D = RF + RZ + RB, (2)
где RF, RZ, RB – скорости трат гидробионтов на обмен.
Расчет μF выполним по М-модели:
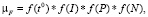 (3)
(3)
где t ° – температура воды, I – освещенность в слое толщиной Н; f(P), f(N) – функции влияния биогенов (фосфора и азота) на рост планктонных водорослей.
Функцию влияния температуры воды зададим по [5]:
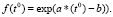 (4)
(4)
Функцию влияния освещенности зададим по [4]:
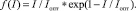 (5)
(5)
Среднюю интегральную освещенность I в слое толщиной Н рассчитаем по [5] по формуле
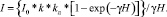 (6)
(6)
В (6): I0 – поступающая на поверхность воды суммарная за сутки солнечная радиация; k – коэффициент экстинкции, kл – коэффициент влияния льда (и снега на поверхности льда) на ослабление света, γ – показатель ослабления света взвесью. Параметры kл и γ –найдем из эмпирических уравнений: kл = α – βΔ, где α = 0,797; β = 0,014; Δ – толщина льда в см [5]. В случае отсутствия льда kл = 1,0. Коэффициент ослабления света взвесью γ рассчитаем по формуле
γ = a(Bs + M) + b, (7)
где а = 0,141; b = 0,164; ВS – суммарная взвесь (F + Z + B + Д); M – мутность воды, (мг/л) по [5] является функцией скорости ветра W:
M = (aW)b + c, (8)
где а = 0,368; b = 2,22; с = 7,0.
Влияние биогенов рассчитаем по модели Михаэлиса – Ментен – Монó [4]:
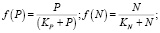
где
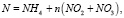
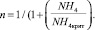 (9)
(9)
Параметры полунасыщения по биогенам: KP = 20 мкг Р/л, KN = 35 мкг N/л; критическая концентрация аммонийного азота NH4крит. = 17 мкг N/л. Дополнительно может быть учтено влияние загрязняющих веществ, например тяжелых металлов, на μF [5].
Скорость трат на обмен у фитопланктона RF рассчитаем по формуле
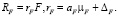 (10)
(10)
Доля aF трат на обмен фитопланктона от величины μF задана по эмпирическому уравнению
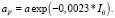 (11)
(11)
Параметр ΔF задан равным 5 % от величины aF*μF для января.
Скорость трат на обмен зоопланктона RZ = rZZ, где rZ – интенсивность трат на обмен зоопланктона, зависящая от среднего веса организмов (WZ) и температуры воды [5]:
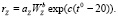 (12)
(12)
Скорость трат на обмен бактерий (RB), ассоциированных с детритом принята равной 60 % от валовой бактериальной продукции Ввал, рассчитываемой по эмпирической формуле из [4]: Ввал = 0,0087*(t0)2*B.
Результаты исследования и их обсуждение
Рассчитаем D:Рвал по формулам (1–12)для месяцев года с различными вариантами задания мощности (толщины) продукционного слоя: 1,0; 1,5; 2,0; 3,0; 4,0; 5,0 м. Значения температуры воды (t °) по месяцам года зададим по наблюдениям в Невской губе по ГМП «Лисий нос». Значения I0 и скорости ветра (W) зададим по средним многолетним данным для широты г. Санкт-Петербурга. Зададим расчетные параметры функций (3)–(8): k = 0,5; Iопт = 1,5 МДж/м2сут. Для расчета rz зададим: WZ = 10-4 мг сух. веса; az = 0,06; b = − 0,25; c = 0,1. Биомассу фитопланктона (F), зоопланктона (Z), бактерий (B), ассоциированных с детритом (Д) зададим рекогносцировочно по результатам моделирования мелководной экосистемы [5]. Концентрацию минерального фосфора (Р), аммонийного азота (NH4); нитритов (NO2); нитратов (NO3) по месяцам года также зададим по результатам моделирования. Оценим возможности самоочищения водной экосистемы на годовом интервале ее функционирования по величине D:Рвал. Приведенный алгоритм дает возможность оценить также вклад в самоочищение компонентов биоты по отдельности. Для этого необходимо рассчитать отношения RF/Рвал; RZ/Рвал; RB/Рвал [5].
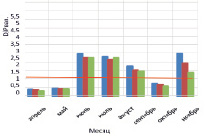
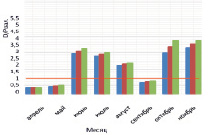
На рисунке приведены некоторые результаты моделирования изменчивости D/P в расчетных сценариях 1 и 2:
а) б)
в) г)

д) е)
Внутригодовая изменчивость D/P в расчетных сценариях (пояснение в тексте)
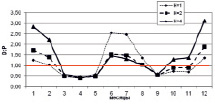
1. Влияние Н и температуры воды на D/P. Рассчитывается средняя интегральная освещенность I в слое толщиной Н = 1,5 м. Параметр а в функции (11) задан равным 0,25. Толщина льда зимой 30 см. Результаты по изменению параметра Н приведены на рисунке, а, изменение Н: Н = 1,5 м (синий); 2 м (коричневый); 3 м (зеленый). На рисунке, б: представлены результаты изменения D/P при изменении температуры воды в безледный период: исходный ряд температуры воды (синий); температура воды в безледный период увеличена на 1 °С (коричневый); температура воды в безледный период увеличена на 2 °С (зеленый). Рисунок, в, иллюстрирует вклад отношений RF/Рвал (синий); RZ/Рвал (коричневый); RB/Рвал (серый) в суммарное D/P.
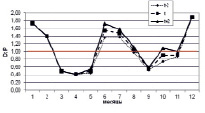
2. Влияние Н, температуры воды и концентраций минеральных азота и фосфора на D/P. Рассчитывается средняя интегральная освещенность I в слое толщиной Н = 2,0 м. Параметр а в функции (11) задан равным 0,59 (имитируется гипотетический переход фитопланктона на активный обмен, который может быть обусловлен загрязнением экосистемы). Толщина льда зимой нарастает от 30 см в декабре до 50 см в феврале, затем снижается до 30 см в апреле. Рисунок, г, отражает изменение Н: Н = 2,0 м (квадраты); 1 м (ромбы); 4 м (треугольники). Рисунок, д, отражает изменение температуры воды: исходный ряд температуры воды (квадраты); температура воды в безледный период уменьшена на 2 °С (ромбы); температура воды в безледный период увеличена на 2 °С (треугольники). Рисунок, е, отражает увеличение концентрация биогенов (минеральный азот и фосфор) в 2 раза (треугольники) на фоне внутригодового изменения D/P при исходной концентрации биогенов (квадраты).
Во всех экспериментах выявлена ведущая роль бактерий в деструкции органического вещества в экосистеме. Динамика D/P – отношения при H = 5,0; 3,0; 2,5 м характеризуется максимумом D/P в июне – июле (2,2–1,6), который обусловлен усилением деструкции с ростом температуры воды на фоне роста продукции. D/P < 1 отмечено на временных промежутках январь (февраль) – май и август – ноябрь (декабрь) (до 0,4). Отличительной особенностью этих периодов является то, что значения D/P < 1 вызваны сравнительно низкой деструкцией на фоне роста продукции.
В эксперименте с Н = 2,5; 2,0; 1,5 м весной (апрель – май) отмечены D/P < 1 (порядка 0,4), летом D/P > 1 (1,7–2,45), осенью выявлены значения D/P < 1 (0,6–0,7), которые приходятся на сентябрь (октябрь). Зимние значения D/P > 1 обусловлены снижением скорости продуцирования органического вещества на фоне низкой скорости деструкции. Летние D/P > 1,0 характеризуются опережающим ростом деструкции на фоне увеличения первичной продукции в водоеме. Осенние D/P < 1 обусловлены возрастанием продукционной способности на фоне общего постепенного снижения деструкции в водной экосистеме.
Также был выполнен эксперимент, характеризующий возможный недоучет суммарного разложения органического вещества в экосистеме за счет минерализации растворенного органического вещества. Скорость минерализации растворенного органического углерода, азота, фосфора в расчетах зависела от температуры воды [5]. Таким образом, скорость деструкции бактериями взвешенного органического вещества и скорость минерализации растворенного органического вещества (М) оценивались суммой М + RF + RZ + RB или (М + D).
Анализ изменчивости (M+D)/P при H = 2,5 м выявил (M + D)/P > 1 на промежутке июнь – июль (до 1,75) и в декабре (до 2,2). Значения (M + D)/P < 1 отмечены на промежутке январь – май (0,35), август – ноябрь (0,55). Отмечен максимум (M + D)/P в январе (2,2), который обусловлен не усилением процесса деструкции и минерализации, а снижением продуктивности фитопланктона. Минимум (M + D)/P в апреле – мае (0,35) связан с увеличением продукции в водоеме (весенний максимум вегетации фитопланктона). Анализ результатов показывает, что дополнительный учет при расчете D/P скоростей минерализации растворенных органических углерода, азота, фосфора не сильно сказывается на результатах моделирования D/P-отношения.
Заключение
Разработка методов мониторинга скоростей массообмена между компонентами водных экосистем, моделирование процессов массообмена, зависимости скоростей процессов от влияющих на них факторов является актуальной задачей современной водной экологии, системного моделирования и системного нормирования. Мониторинг наземных и водных экосистем целесообразно развивать за счет оценки скоростей процессов, характеризующих массообмен в экосистемах и экосистемные функции.
Оценка внутригодовой изменчивости скоростей массообмена и соотношений между ними дает исследователю необходимую информацию для оценки экологического состояния водного объекта, его простых и сложных свойств и может использоваться для доказательства адекватности моделей водных экосистем. Современные акценты исследований: 1 – разработка индикаторов оценки экологического состояния водных экосистем; 2 – интегральная оценка эмерджентных свойств водных объектов (экосистем): устойчивость, экологический статус, экологическое благополучие, экологическая напряженность и др.; 3 – разработка индикаторов системных свойств.
Информация о скоростях массообмена в экосистеме может использоваться для принятия управленческих решений при планировании воздействия на водные объекты и их экосистемы.
Исследования выполнялись при поддержке гранта РФФИ №18-05-60291 а.



