В последние десятилетия вырос интерес синтетиков к органическим телланам и органителланильным субстратам. В известном обзоре [1] и книге [2] систематически раскрыт синтетический потенциал функционализированных телланов и других органилтеллуристых соединений.
Найдены ранее неизвестные диорганилтелланы с высокой биологической активностью [3–5]. Многие диорганилтелланы обнаруживают высокую глутатионпероксидаза-подобную активность, т.е. являются катализаторами разложения перекисей под действием соединений, содержащих тиольную функцию, например, глутатиона [6–8]. Соединения с тиольной функцией при этом превращаются в соответствующие дисульфиды.
Следует отметить, что ранее в отношении глутатионпероксидаза-подобной активности интенсивно изучались селенорганические соединения [6, 7]. Однако в 2018 г. вышла фундаментальная работа, в которой исследована глутатионпероксидаза-подобная активность функционализированных диорганилтелланов [8]. В этой работе показано, что диорганилтелланы обладают более высокой глутатионпероксидаза-подобной активностью, чем аналогичные селенорганические соединения.
Ранее было установлено, что наличие гидроксигруппы в молекуле диорганилхалькогенидов, как правило, увеличивает глутатионпероксидаза-подобную активность [6, 7]. В работе 2018 г., в которой изучена биологическая активность функционализированных диорганилтелланов, было показано, что наибольшую глутатионпероксидаза-подобную активность проявляют телланы, которые содержат гидроксигруппы, бис(гидроксиалкил)телланы [8].
До настоящих исследований нами синтезированы новые семейства ранее неизвестных функционализированных диорганилтелланов на базе реакций TeCl4 [9–11]. Нами систематически разработан новый подход к процессу алкоксителлурирования [9]. Однако если в субстрате имеется удаленная от двойной связи гидроксильная функция, то может реализоваться циклофункционализация за счет нуклеофильного замещения внутримолекулярного типа. Например, взаимодействие 2-аллил-1-гидроксибензола с четыреххлористым теллуром приводит к трихлор(2,3-дигидро-1-бензофуран-2-илметил)теллану [11]. Если циклизации не происходит, наблюдается образование функционализированного гидроксиалкилтеллана. Реакция тетрагалогенидов теллура с бут-3-ен-1-олом не описана в литературе.
Цель исследования: изучение реакций четыреххлористого и четырехбромистого теллура с бут-3-ен-1-олом (1) и разработка на основе этих реакций эффективных региоселективных методов синтеза ранее неизвестных функционализированных теллурорганических соединений − перспективных полупродуктов для получения веществ с высокой глутатионпероксидаза-подобной активностью.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker DPX-400 на рабочих частотах 400,13 и 100,61 МГц соответственно, в ДМСО-d6, внутренний стандарт – ГМДС. Для элементного анализа использован прибор Thermo Finigan EA 1112. В реакциях использовались осушенные и перегнанные растворители.
(4-Гидрокси-2-хлорбутил)трихлортеллан (2). К смеси четыреххлористого теллура (0,539 г, 2 ммоль) и 25 мл четыреххлористого углерода при перемешивании добавили по каплям раствор бут-3-ен-1-ола (0,144 г, 2 ммоль) в 5 мл четыреххлористого углерода и перемешивали смесь при комнатной температуре в течение 48 ч. Растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Получили 0,683 г (выход количественный) (4-гидрокси-2-хлорбутил)трихлортеллана (2) в виде вещества светло-серого цвета.
Спектр ЯМР 1H, δ, м.д.: 1,98–2,18 м (2H, CH2), 3,12 с (1H, OH), 3,89–3,98 м (2H, CH2O), 4,56–4,78 м (3H, CHCl, TeCH2). Спектр ЯМР 13С, δ, м.д.: 38,1 (CH2), 58,6 (CHCl), 59,3 (CH2O), 68,9 (Cl2TeCH2). Найдено, %: С 13,83; H 2,54; Cl 41,27; Te 37,09. С4H8Cl4OTe. Вычислено, %: С 14,07; H 2,36; Cl 41,52; Te 37,36.
Попытка внутримолекулярной циклизации (4-гидрокси-2-хлорбутил)трихлортеллана. Раствор (0,342 г, 1 ммоль) 4-гидрокси-2-хлорбутил)трихлортеллана в 20 мл четыреххлористого углерода нагревали до кипения при перемешивании в течение 8 ч. Растворитель отогнали на роторном испарителе, остаток сушили в вакууме и анализировали методом ЯМР 1Н и 13С. Остаток по данным ЯМР 1Н и 13С представляет собой исходный 4-гидрокси-2-хлорбутил)трихлортеллан в виде вещества светло-серого цвета. Продукта внутримолекулярной циклизации не обнаружено.
Бис(4-гидрокси-2-хлорбутил)дихлортеллан (6). К смеси четыреххлористого теллура (0,539 г, 2 ммоль) и 20 мл бензола при перемешивании добавили по каплям раствор бут-3-ен-1-ола (0,288 г, 4 ммоль) в 5 мл бензола и нагревали смесь при перемешивании до кипения в течение 18 ч. Смесь фильтровали, растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Получили 0,794 г (выход 96 %) бис(4-гидрокси-2-хлорбутил)дихлортеллана в виде вещества светло-серого цвета.
Спектр ЯМР 1H, δ, м.д.: 1,96–2,28 м (4H, CH2), 3,02 с (2H, OH), 3,78–3,95 м (4H, CH2O), 4,43–4,72 м (6H, CHCl, TeCH2). Спектр ЯМР 13С, δ, м.д.: 36,3 (CH2), 56,1 (CH2Te), 58,7 (CHCl), 59.8 (CH2O). Найдено, %: С 23,51; H 3,72; Cl 34,57; Te 31,12. С8H16Cl4O2Te. Вычислено, %: С 23,23; H 3,90; Cl 34,29; Te 30,85.
(4-Гидрокси-2-метоксибутил)трибромтеллан (7). К смеси 0,894 г (2 ммоль) четырехбромистого теллура и 25 мл метанола добавили по каплям раствор бут-3-ен-1-ола (0,144 г, 2 ммоль) в 5 мл метанола. Реакционную смесь перемешивали при нагревании до 50–60 °С в течение 8 ч. Растворитель удаляли на роторном испарителе, остаток сушили в вакууме. Получили 0,941 г (выход количественный) (4-гидрокси-2-метоксибутил)трибромтеллана в виде вещества темно-желтого цвета.
Спектр ЯМР 1H, δ, м.д.: 1,86–2,11 м (2H, CH2), 3,22 с (3H, CH3O), 3,56–3,75 м (2H, CH2O), 3,86–3,97 м (1H, CHO), 4,25–4,49 м (2H, TeCH2). Спектр ЯМР 13С, δ, м.д.: 31,8 (CH2), 56,3 (CH3O), 60,4 (TeCH2), 61,5 (CH2O), 72,2 (CHO). Найдено, %: С 13,05; H 2,54; Br 51,16; Te 26,87. С5H11Br3O2Te. Вычислено, %: С 12,77; H 2,36; Br 50,95; Te 27,12.
Бис(4-гидрокси-2-метоксибутил)дителлан (8). К охлаждённой до 0 °С смеси 0,471 г (1 ммоль) (4-гидрокси-2-метоксибутил)трибромтеллана 7 и 20 мл бензола при перемешивании добавили охлаждённый до 0 °С раствор 1,2 г (6,3 ммоль) Na2S2O5 в 10 мл воды. Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Органический слой отделили, фильтровали, сушили Na2SO4. Растворитель удаляли на роторном испарителе, остаток сушили в вакууме. Получили бис(4-гидрокси-2-метоксибутил)дителлан (0,415 г, выход 90 %) в виде темно-красного масла.
Спектр ЯМР 1H, δ, м.д.: 1,72–2,01 м (4H, CH2), 2,94–3,23 м (4H, TeCH2), 3,28 с (6H, CH3O), 3,49–3,74 м (4H, CH2O), 3,76–4,03 м (2H, CHO). Спектр ЯМР 13С, δ, м.д.: 13,1 (TeCH2), 37,2 (CH2), 55,9 (CH3O), 61,3 (CH2O), 71,4 (CH2O). Найдено, %: С 25,75; H 4,64; Te 54,98. С10H22O4Te2. Вычислено, %: С 26,03; H 4,81;Te 55,30.
Результаты исследования и их обсуждение
Впервые осуществлено и систематически изучено взаимодействие четыреххлористого и четырехбромистого теллура с бут-3-ен-1-олом (1) в различных экспериментальных условиях.
В работах [10, 11] нами описано взаимодействие гексенола и 2-аллилфенола с четыреххлористым теллуром. Процессы реализуются при кипячении в CCl4 и сопровождаются циклизацией внутримолекулярного типа с образованием 6-членного и 5-членного кислородсодержащих гетероциклов: (тетрагидро-2H-пиран-2-илметил)трихлортеллана и (2,3-дигидро-1-бензофуран-2-илметил)трихлортеллана с практически количественными выходами (Схема 1).
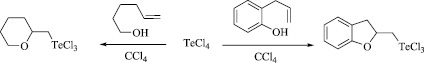
Схема 1. Реакции четыреххлористого теллура с гекс-5-ен-1-олом и 2-аллилфенолом
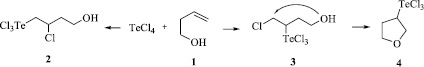
Схема 2. Возможные пути реакции четыреххлористого теллура с бут-3-ен-1-олом
Если теоретически рассмотреть возможные пути реакции четыреххлористого теллура с бутенолом 1, то можно предположить, что процесс может привести как к Марковниковскому продукту 2, так и к продукту присоединения против правила Марковникова 3, который может подвергаться циклизации внутримолекулярного типа, давая гетероцикл 4 (Схема 2).
Установлено, что реакция четыреххлористого теллура с бутенолом 1 в среде CCl4 как при кипячении, так и при комнатной температуре приводит к продукту присоединения по правилу Марковникова, (4-гидрокси-2-хлорбутил)трихлортеллану (2), с количественным выходом (Схема 3).
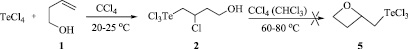
Схема 3. Синтез (4-гидрокси-2-хлорбутил)трихлортеллана (2) реакцией четыреххлористого теллура с бут-3-ен-1-олом
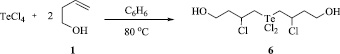
Схема 4. Синтез бис(4-гидрокси-2-хлорбутил)дихлортеллана (6) реакцией четыреххлористого теллура с бут-3-ен-1-олом
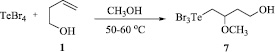
Схема 5. Синтез (4-гидрокси-2-метоксибутил)трибромтеллана (7) из четырехбромистого теллура и бутенола 1
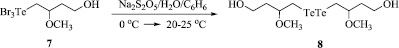
Схема 6. Синтез бис(4-гидрокси-2-метоксибутил)дителлана (8)
Найдено, что нагревание соединения 2 в кипящих растворителях (хлороформ, четыреххлористый углерод) не сопровождается гетероциклизацией с образованием возможного продукта 5 (Схема 3).
Разработаны экспериментальные условия для хемоселективного синтеза бис-аддукта, бис(4-гидрокси-2-хлорбутил)дихлортеллана (6). Оптимальными условиями для получения соединения 6 является нагревание до кипения четыреххлористого теллура с двукратным избытком бутенола 1 в среде бензола в течение 18 ч. При этом выход продукта 6 составляет 96 % (Схема 4).
Ранее нами был разработан новый подход к одновременному введению в органический субстрат теллуристого заместителя и спиртовой функции. Этот подход использован для алкоксителлурирования бутенола 1. Ранее неизвестный (4-гидрокси-2-метоксибутил)трибромтеллан (7) синтезирован с выходом 100 % взаимодействием TeBr4 с бутенолом 1 (Схема 5).
Новое соединение бис(4-гидрокси-2-метоксибутил)дителлан синтезирован с выходом 90 % восстановлением соединения 7 (Схема 6).
Можно предполагать, что синтезированный нами бис(4-гидрокси-2-метоксибутил)дителлан 8 может быть источником новых электрофильных субстратов: (4-гидрокси-2-метоксибутил)телланилгалогенидов и (4-гидрокси-2-метоксибутил)телланилтригалогенидов [1, 2].
Строение синтезированных соединений надежно доказано методами ЯМР 1Н и 13С и подтверждено данными элементного анализа (C, H, Te, Cl, Br).
Заключение
На основе систематических исследований ранее неизвестных реакций четыреххлористого и четырехбромистого теллура с бут-3-ен-1-олом разработаны эффективные региоселективные методы синтеза новых функционализированных гидроксибутилтелланов: (4-гидрокси-2-хлорбутил)трихлортеллана (2), бис(4-гидрокси-2-хлорбутил)дихлортеллана (6), (4-гидрокси-2-метоксибутил)трибромтеллана (7) и бис(4-гидрокси-2-метоксибутил)дителлана (8) с выходами до количественного. Полученные продукты являются перспективными субстратами и реагентами для микро- и наноэлектроники.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-33-60199_мол_а_дк).
Авторы благодарят Байкальский аналитический центр коллективного пользования Сибирского отделения Российской академии наук за спектральные исследования и элементный анализ.



