Проведенные экспериментальные исследования растворения оксидных фаз позволяют детально описать процессы поведения твердой фазы в кислой среде, объяснить явления, протекающие на поверхности оксидов, с учетом их кислотно-основных характеристик и механизма растворения, провести моделирование топохимических реакций.
Цель исследования состоит в изучении и моделировании процесса растворения Со3О4 и Fe3O4 в серной кислоте.
Материалы и методы исследования
Для исследований брали образцы массой 500 мг с d = 80÷100 мкм. Идентификацию оксидов проводили методами рентгенофазового, ИК- и термоанализами.
Для выяснения механизма растворения твердых образцов оксидов металлов в кислых средах эксперимент проводился в приборе (термостатируемый реактор объемом 0,5 л) для изучения кинетики растворения твердых образцов, исключающем влияние, каких-либо неконтролируемых факторов на изучаемое явление. Температура опыта 363 К. Эксперимент проводился при различных значениях рН и концентрациях минеральной кислоты.
Через определенные промежутки времени проводили отбор проб жидкой фазы из реакционного сосуда стеклянным фильтром Шотта. Концентрацию ионов кобальта определяли спектрофотометрически (спектрофотометр УФ-3100) с помощью роданида аммония, а железа – с помощью о-фенантролина.
Полученные экспериментальные данные по влиянию концентрации кислоты на скорость растворения оксида кобальта Co3O4 и Fe3O4 представлены на рис. 1 (точки – данные эксперимента, линии – результат моделирования). Долю растворенного вещества a рассчитывали по уравнению: a = Dt/D∞.
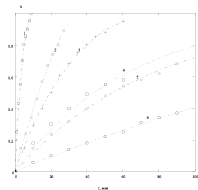
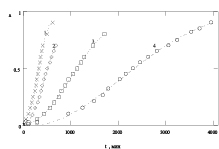
а б
Рис. 1. а) зависимость доли растворенного оксида Со3О4 от времени при различных концентрациях серной кислоты (моль/л): 1 – 10,0; 2 – 5,93; 3 – 2,97; 4 – 1,0; 5 – 0,57; 6 – 0,12; Т = 363,2 К; б) зависимость доли растворенного оксида Fe3О4 от времени при различных концентрациях серной кислоты (моль/л): 1 – 10,3; 2 – 7,82; 3 – 3,86; 4 – 2,44; Т = 293 К
Результаты исследования и их обсуждение
Расчет кинетических параметров. Был проведен анализ экспериментальных кинетических данных с помощью уравнений гетерогенной кинетики, который позволил определить порядки реакций по различным ионам (ni), удельную скорость растворения (Wi), ее зависимость от концентрации раствора, а также энергии активации реакций (Еа) [1–4].
Кинетика гетерогенных реакций базируется на обязательном учете изменения поверхности частиц в процессе растворения во времени, кроме того, как правило, гетерогенные реакции характеризуются постоянством скорости во времени (1) [5–7].
В этом случае скорость растворения оксида можно представить уравнением [8]:
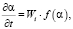 (1)
(1)
где Wi – удельная скорость растворения; f(α) – функция, которая учитывает, как меняется поверхность оксида с течением времени.
Для выяснения механизма растворения и моделирования этого явления брали модель Бартона – Странского (2):
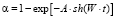 ,
,
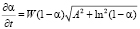 , (2)
, (2)
где A – константа. Ее значение прямо пропорционально числу активных центров на поверхности одной частицы оксида.
Для нахождения значений переменных W и A использовались методы нелинейного регрессионного анализа и компьютерная программа MathCad.
Таблица 1
Удельная скорость растворения оксидов Co3O4 и Fe3O4 в зависимости от концентрации H2SO4
|
[H2SO4], моль/л |
lg W, мин-1 |
[H2SO4], моль/л |
lg W, мин-1 |
|
Co3O4 |
Fe3O4 |
||
|
0,12 |
– 2,9 |
2,44 |
– 3,5 |
|
0,57 |
– 2,5 |
3,86 |
– 3,1 |
|
1,00 |
– 2,4 |
7,82 |
– 2,8 |
|
2,97 |
– 2,1 |
10,3 |
– 2,6 |
|
5,93 |
– 1,9 |
||
|
10,00 |
– 1,6 |
||
Из данных таблицы и рис. 2 (точки – экспериментальные данные, линии – результат моделирования по уравнению (3)) следует, что оксид кобальта Co3O4 растворяется быстрее в серной кислоте, чем оксид железа Fe3O4. Порядок реакции по ионам водорода для двух оксидов равен приблизительно 0,5. (все результаты получены на основе модели Бартона – Странского).
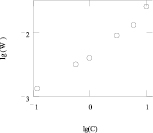

а б
Рис. 2. а) зависимость логарифма скорости (lg W) от логарифма концентрации (lg C(H2SO4)) при растворении Со3О4 в серной кислоте; б) зависимость логарифма скорости (lg W) от логарифма концентрации (lg C(H2SO4)) при растворении Fe3O4 в серной кислоте
Полученные данные позволяют описать связь удельной скорости растворения оксидов Со3O4 и Fe3O4 от концентрации H2SO4 обобщенным уравнением
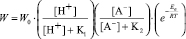 , (3)
, (3)
где [A-]≡[HSO4-], W0 – константа скорости растворения, K1, K2 – постоянные.
Моделирование механизма растворения оксидов кобальта и железа в неорганической кислоте. Растворение оксидов в кислотах происходит на поверхностных дефектах кристаллической решетки, так называемых активных центрах растворения оксидов, адсорбировавших ионы H+ и ионные пары Н+…А-.
Метод Хоугена – Ватсона позволяет провести моделирование влияния рН и концентрации кислот на скорость растворения оксидов [8–10].
В этом случае скорость растворения оксидов кобальта и железа будет выражаться уравнением [9–10]:
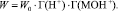 (4)
(4)
Предположительно на поверхности оксидов образуются частицы гидроксокомплексов металлов такого же состава, что и находящиеся в растворе. Для расчета концентрации гидроксокомплексов использовали уравнения материального баланса в реакциях гидролиза по ионам водорода, кобальта и железа; уравнения гидролиза по всем ступеням для расчета констант гидролиза [2, 8]. Метод Хоугена – Ватсона предполагает, что зависимость концентрации ионов на поверхности оксидов и в растворе подчиняется изотерме Ленгмюра, что позволяет связать поверхностную и объемную концентрации ионов (уравнение (5)).
Зависимость удельной скорости растворения оксидов кобальта Со3О4 и Fe3O4 в разбавленной серной кислоте выражается уравнениями (5–7).
Концентрацию ионов 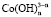 и
и 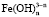 можно выразить через общую концентрацию ионов Co3+ и Fe3+, если установлено их содержание в растворе. В этом случае
можно выразить через общую концентрацию ионов Co3+ и Fe3+, если установлено их содержание в растворе. В этом случае 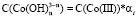 и
и 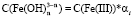 . Тогда скорость равна
. Тогда скорость равна
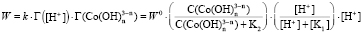 ,
,
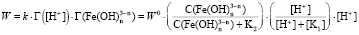 . (5)
. (5)
Если проводить моделирование процесса растворения оксида и принять, что ионы  и
и  выступают в качестве поверхностно-активных частиц, то зависимость скорости процесса от концентрации ионов будет выглядеть следующим образом (a1 – количество ионов в растворе):
выступают в качестве поверхностно-активных частиц, то зависимость скорости процесса от концентрации ионов будет выглядеть следующим образом (a1 – количество ионов в растворе):
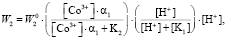
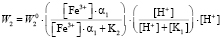 . (6)
. (6)
для ионов  и
и  :
:
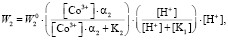
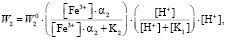 (7)
(7)
где a2 – доля ионов 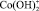 и
и 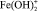 , W0 – удельная константа скорости растворения; K1, K2 – величины обратные константам адсорбции.
, W0 – удельная константа скорости растворения; K1, K2 – величины обратные константам адсорбции.
Чтобы выбрать поверхностно-активную частицу и проверить верность представленных уравнений, было проведено моделирование влияния различных значений рН на скорость растворения оксидов кобальта при различных значениях рН [10]. (Для магнетита моделирование аналогичное.) Результаты, полученные при моделировании, показаны на рис. 3.
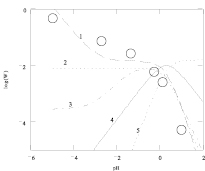
Рис. 3. Результаты моделирования влияния концентрации серной кислоты на удельную скорость растворения Со3О4 с учетом присутствия в растворе сульфато- и гидроксокомплексов кобальта (3+). Точки – эксперимент, линии – моделирование с участием ионов: 1 – 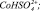 2 –
2 – 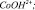 3 –
3 – 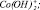 4 –
4 – 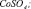 5 –
5 – 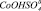
Результаты моделирования показали, что на поверхности оксида кобальта Со3О4 и железа Fe3O4 присутствует активная частица  и
и 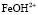 в случае низкой концентрации ионов водорода. При увеличении концентрации серной кислоты скорость растворения начинает определять другая поверхностно-активная частица, а именно
в случае низкой концентрации ионов водорода. При увеличении концентрации серной кислоты скорость растворения начинает определять другая поверхностно-активная частица, а именно 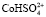 и
и 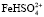 .
.
Выводы
1. На основе изучения кинетики растворения твердых фаз в растворах кислот показано, что необходимо учитывать влияние природы центров растворения оксидов на скорость реакции.
2. Разработан анализ кривых растворения (α-t) оксидов для расчета кинетических параметров (Wi, 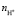 , Eак). Модель Бартона – Странского оптимальна для описания механизма растворения с учетом фрактальной геометрии.
, Eак). Модель Бартона – Странского оптимальна для описания механизма растворения с учетом фрактальной геометрии.
3. Нами установлено, что оксид кобальта Co3O4 растворяется быстрее в серной кислоте, чем оксид железа Fe3O4. Порядок реакции по ионам водорода для двух оксидов равен приблизительно 0,5.
4. При моделировании процессов растворения показано, что на поверхности оксида кобальта Со3О4 и Fe3O4 присутствует активная частица 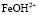 и
и 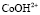 .
.



