Интенсификация процессов в промышленности, энергетике, электротехнике и других отраслях привела к созданию новых композиционных материалов с улучшенными техническими характеристиками. Значительный интерес представляют материалы на основе силикатов и других тугоплавких неметаллических соединений, в частности, композиты на основе слюды и специальных стекол [1, 2, 4, 8, 12]. Особое место в этом ряду занимает микалекс – композиционный материал, получаемый методом горячего прессования из природной слюды или ее отходов и легкоплавкого стекла [9]. При изготовлении композита тонко измельченную смесь из слюды и стекла подвергают высокотемпературному нагреву, при котором происходит дегидроксилация слюды. Раннее на основании применения термодинамических, квантово-химических и экспериментальных методов исследования нами получены новые результаты по процессам дегидратации и дегидроксилации слюд [3, 5–14]. Определено, что вода выходит из слюды вследствие нагрева в несколько этапов: сначала выходит примесная вода, затем межслоевая (процесс дегидратации и начало дегидроксилации), при дальнейшем увеличении температуры происходит дегидроксилация. Было установлено:
– процесс дегидроксилации мусковита включает три последовательных этапа: изомерные перегруппировки в гексагональной области, связанные с переходом гидроксильных ионов в позиции цис-транс или цис-цис ориентации; протонирование; миграция образовавшейся воды в межслоевое пространство [14];
– лимитирующей стадией процесса дегидроксилации является либо диффузия молекул воды в межслоевом пространстве (Арябиловский и Каталахский флогопиты), либо перестройка гидроксильных ионов с образованием воды (Ковдорский флогопит и мусковит). Определены кинетические параметры процесса дегидроксилации для мусковита и флогопита (константа скорости, энергия активации, коэффициент диффузии воды в межслоевом пространстве) при температуре 700–900 °С [11].
Исследование дегидроксилации в системе «слюда – стекло» при повышенных температурах представляет большой практический и научный интерес, поскольку получение композиционных материалов с заданными свойствами возможно на основе четких и явных представлений о механизме межфазовых взаимодействий в системе «слюда – стекло», которые начинаются с процесса дегидроксилации слюды в данной системе.
Следует отметить, что появление новых фаз в продуктах спекания композита следует рассматривать как результат взаимодействия со стеклом не исходной слюды, а ее дегидроксилата, поэтому изучение дегидроксилации слюды в системе «слюда – стекло» актуально. Интересно также выяснить вопрос, в какой степени наличие стекла в исходной смеси оказывает влияние на скорость дегидроксилации.
В связи с этим были проведены опыты по дегидроксилации слюд в различных стеклах. Опыты проводили при тех же условиях, что и с чистой слюдой, приведенных нами ранее [11, 12]. Навеска смеси слюды и стекла в весовом процентном соотношении 60:40 составляла 500 мг.
Требование к стеклу для композиционного материала: оно должно хорошо смачивать слюду, быть устойчивым к фазовым переходам в интервале температур формирования композита, иметь хорошие электрофизические свойства и быть устойчивым к воде. Нами разработаны специальные составы стекол 203, 15, 35, химические составы которых приведены в табл. 1 [8]. Все указанные стекла обладают хорошей адгезией к мусковиту и флогопиту. Стекла 15 и 35 обладают более высокими температурой размягчения, химической стойкостью, диэлектрическими и механическими свойствами, чем стекло 203.
Таблица 1
Химический состав стекол
|
Стекла |
Химический состав стекол, масс. % |
||||||||||
|
SiO2 |
Al2O3 |
B2O3 |
Na2O |
K2O |
BaO |
ZnO |
CaF2 |
CaO |
MgO |
P2O5 |
|
|
203 |
20,5 |
4,0 |
23,0 |
8,0 |
12,2 |
14,0 |
10,0 |
8,3 |
– |
– |
– |
|
15 |
20,0 |
20,0 |
25,0 |
6,0 |
9,0 |
– |
– |
– |
– |
– |
20,0 |
|
35 |
20,8 |
20,8 |
26,0 |
6,3 |
9,3 |
4,2 |
4,2 |
– |
4,2 |
4,2 |
– |
Предварительными опытами установлено, что потери массы стекол в стационарном режиме не превышают 0,05 %. Таким образом, можно считать, что потери массы в смеси обусловлены дегидроксилацией слюды. Условия проведения эксперимента (скорость нагрева, чувственность весов, крупность слюды) соблюдались такими же, как при исследовании чистых слюд. Изотермическая кинетика дегидроксилации слюд в среде размягченного стекла исследовалась в интервале температур 600–1000 °С. Образцами служили смеси слюд (мусковита, Ковдорского и Арябиловского флогопитов) со стеклами. Прогрев смесей в стационарном режиме – 60 минут, время прогрева до станционного режима в зависимости от температуры составляло 30–40 минут. Результаты представлены в табл. 2.
Таблица 2
Потери массы при дегидроксилации различных слюд в смесях со стеклами
|
Слюда |
Потери массы в стационарном режиме, % (при температуре, °С) |
||||
|
600 |
700 |
800 |
900 |
1000 |
|
|
Мусковит |
0,42 |
0,92 |
2,64 |
– |
– |
|
Мусковит + стекло 203 |
0,79 |
2,11 |
3,70 |
– |
– |
|
Мусковит + стекло 15 |
0,77 |
1,57 |
2,77 |
– |
– |
|
Мусковит + стекло 35 |
0,50 |
1,10 |
2,27 |
– |
– |
|
Флогопит Ковдор |
– |
0,14 |
0,32 |
0,54 |
1,30 |
|
Флогопит Ковдор + стекло 203 |
– |
0,73 |
0,90 |
1,97 |
3,42 |
|
Флогопит Ковдор + стекло 35 |
– |
1,27 |
1,13 |
2,17 |
4,17 |
|
Флогопит Арябиловский |
– |
0,16 |
0,18 |
0,26 |
1,4 |
|
Флогопит Арябиловский + стекло 203 |
– |
0,53 |
0,60 |
1,07 |
1,52 |
|
Флогопит Арябиловский + стекло 35 |
– |
0,80 |
1,00 |
1,46 |
1,56 |
Из сравнения данных табл. 2 видно, что наличие стекла в исходной смеси влияет на процесс дегидроксилации слюды, значительно интенсифицируя его. Мусковит интенсивнее всего дегидроксилирует в стеклах 203 и 15, а Арябиловский флогопит – в стекле 35.
Для исследованных систем «мусковит – стекло» кривая Аррениуса имеет линейный характер, что свидетельствует о том, что процесс дегидроксилации в исследованном температурном интервале протекает по одному и тому же механизму. Аналогичные исследования были проведены для системы «флогопит – стекло». В смесях с 203 и 15 стеклами кривая Аррениуса имеет излом, что свидетельствует об изменении режима удаления воды: при различных температурах меняется лимитирующая стадия процесса.
Исследования газовыделения из смесей показали, что, как и в случае чистых слюд, зависимость изменения массы во времени имеет криволинейный характер и хорошо описывается уравнением диффузионной кинетики (1) [11].
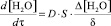 , (1)
, (1)
где 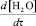 – скорость удаления воды; D – коэффициент диффузии воды в межслоевом пространстве; S – суммарная поверхность, образованная межслоевым пространством и периферийными размерами частичек слюды;
– скорость удаления воды; D – коэффициент диффузии воды в межслоевом пространстве; S – суммарная поверхность, образованная межслоевым пространством и периферийными размерами частичек слюды; 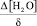 – градиент концентрации воды в центре частички слюды и на ее периферии.
– градиент концентрации воды в центре частички слюды и на ее периферии.
Кинетическое уравнение имеет вид
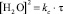 , (2)
, (2)
где kc – константа скорости дегидроксилации. Анализ этого уравнения позволяет считать, что процесс дегидроксилации слюды описывается уравнением нестационарной диффузии.
При обработке кинетических кривых дегидроксилации мусковитовых смесей с использованием уравнения (2) получены результаты, представленные в табл. 3, которые позволяют определить экспериментальную величину константы скорости дегидроксилации слюды в размягченном стекле при различных температурах.
Таблица 3
Значение параметров процесса дегидроксилации мусковита с различными стеклами
|
Характеристика |
Мусковит |
Мусковит + Стекло |
||
|
203 |
15 |
35 |
||
|
Константа скорости, мг2/мин: при 600 °С при 700 °С при 800 °С |
0,051 0,317 1,285 |
0,183 0,737 2,288 |
0,119 0,438 1,259 |
0,073 0,259 0,724 |
|
Коэффициент диффузии, м2/с*109: при 600 °С при 700 °С при 800 °С |
18,70 37,65 46,98 |
11,10 63,40 253,60 |
6,76 32,00 124,10 |
3,48 14,94 78,70 |
|
Энергия активации, кДж/моль: |
122,0 |
134,0 |
118,0 |
120,0 |
По рассчитанным значениям констант скоростей из уравнения Аррениуса определена эффективная энергия активации процесса и экспериментально найденный коэффициент диффузии:
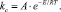 (3)
(3)
Наблюдаемый коэффициент диффузии воды равен
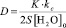 , (4)
, (4)
принимая толщину пакета 10-10 м, величину межслоевого промежутка ~ 0,2/10-10 м, плотность слюды r = 280 кг/м3 и геометрические размеры частиц, можно определить площадь S, через которую происходит диффузия воды. Для навески 0,5 г она равна 6,2/10-4 м2. Зная общий объем диффузионной зоны, можно оценить [H2O]0 при определенной температуре.
Из табл. 3 следует, что стекла 203 и 15 в значительной степени повышают скорость удаления воды из мусковита. Близость значений энергии активации как для чистой слюды, 122 кДж/моль, так и для систем «слюда – стекло», 118–134 кДж/моль, свидетельствует о том, что стекла не меняют лимитирующей стадии процесса. Процесс протекает в диффузионном режиме.
В табл. 4 представлены экспериментально найденные значения коэффициентов диффузии и энергии активации процесса дегидроксилации флогопитов с различными стеклами. В присутствии стекол значительно возрастает коэффициент диффузии воды у флогопитов: для стекла 203 примерно в 5 раз, для стекла 35 – в 20 раз. Инертность Арябиловского флогопита к 203 стеклу, содержащему фтор, обусловлена, вероятно, близким содержанием фтора в слюде и стекле. Диффузии фтора между слюдой и стеклом не происходит. Более активно этот флогопит взаимодействует со стеклом 35, не содержащим фтор.
Таблица 4
Значение параметров процесса дегидроксилации флогопитов с различными стеклами
|
Характеристика |
Арябиловский флогопит |
Арябиловский флогопит + стекло |
Ковдорский флогопит |
Ковдорский флогопит + + стекло 203 |
|
|
203 |
35 |
||||
|
Коэффициент диффузии, м2/с*109: при 700 °С при 800 °С при 900 °С |
8,38 14,57 22,06 |
36,55 96,1 303,9 |
167,0 290,2 635,0 |
0,47 2,62 8,69 |
7,2 10,0 32,6 |
|
Энергия активации, кДж/моль: 700–800 °С 800–900 °С |
5,25 92,0 |
88,0 88,0 |
58,5 69,0 |
139,0 139,0 |
109,5 37,8 |
Значительно возросло значение энергии активации для Арябиловского флогопита при температурах до 800 0С в присутствии всех стекол (примерно в 10 раз). Этот факт свидетельствует об изменении механизма выделения воды. В чистой слюде при этих температурах выделяется в основном молекулярная вода. При температурах выше 800 °С начинается разложение дегидроксилата и образование новых фаз [11]. В присутствии связующего выделение молекулярной воды завершается до 700 °С и во всем исследуемом интервале наблюдается дегидроксилация. Значения энергий активации близки, но в среде 35 стекла несколько ниже. Уменьшение энергии активации дегидроксилации Арябиловского флогопита в размягченном стекле обусловлено диффузией продуктов распада слюды в размягченное стекло, более активной в системе «Арябиловский флогопит – стекло 35».
Дегидроксилация Ковдорского флогопита в присутствии стекла характеризуется энергией активации, более низкой, чем для чистой слюды, в особенности в интервале температур 800– 900 °С.
Таким образом, общие закономерности процесса дегидроксилации, характерные для чистых слюд, наблюдаются и в присутствии стекла. Однако имеют место и существенные отличия, заключающиеся в смещении температурных интервалов и максимумов эффектов дегидроксилации слюд в низкотемпературную область, а также снижение энергий активации, что может быть объяснено разложением дегидроксилата и взаимодействием продуктов разложения с компонентами стекла.
В присутствии размягченного стекла слюдяные частицы адгезионно связываются с ним по поверхности и частично растворяются с торцевых кромок. Это приводит к уменьшению размеров частичек слюды и формированию переходной зоны между слюдой и стеклом переменного состава, дополнительному расслоению частичек слюды силами адгезии.
Энергия активации дегидроксилации слюд в агрессивной среде размягченного стекла уменьшается вследствие разложения дегидроксилата и облегчения диффузии за счет уменьшения размеров частиц и их расслоения размягченным стеклом, за счет диффузии из стекла в слюду ионов с малыми радиусами Ba2+ (0,138 нм), Ca2+ (0,104 нм), Na+ (0,098 нм), взаимодействующих с гидроксилами и облегчающими их выход из октаэдров. Кроме того, из слюды в стекло диффундируют кристаллики новых фаз, продуктов разложения дегидроксилата, которые в чистой слюде замедляют дегидроксилацию. Присутствие стекла, таким образом, интенсифицирует структурное газовыделение.
Формирование переходного слоя определяет механические свойства получаемого композита. Протяженная диффузионная зона с зернами кристаллических фаз в ней цементирует материал, упрочняя его. Влияние различных стекол на процессы в слюдах неоднозначно: в мусковитовом микалексе сильнее влияние 203 стекла, во флогопитовых – 35. Диффузия продуктов распада дегидроксилата в стекло тем интенсивнее, чем выше градиент концентрации элементов, составляющих вновь образующиеся фазы при переходе из слюды в стекло. Так, в мусковитовом микалексе процессы интенсифицируются в большей степени стеклом 203 с низким содержанием алюминия (табл. 1) в виду того, что в стекло диффундируют содержащие алюминий компоненты с образованием санидина, силлиманита, лейцита. В структурное газовыделение из флогопита вносит вклад также диффузия фтора, поэтому фторсодержащее стекло 203 в меньшей степени интенсифицирует процессы во флогопитах, особенно наглядно это видно на примере высокофтористого природного Арябиловского флогопита.
Таким образом:
- Впервые изучена дегидроксилация слюд в системе «слюда – стекло».
- Установлено, что стекла значительно ускоряют процесс дегидроксилации.
- Найдены экспериментальные значения константы скорости, энергии активации процесса дегидроксилации и коэффициенты диффузии для этих систем.
- Для мусковитовых систем стекла практически не меняют лимитирующую стадию процесса дегидроксилации. Для флогопитовых систем процесс переходит из диффузионного режима в кинетический. В интервале температур 700–800 °С происходит удаление воды в диффузионном режиме. Выше 800 °С режим переходит в кинетический. Лимитирующей стадией является разрыв химических связей гидроксильных ионов, начинается процесс разложения дегидроксилата и удаление химически связанной воды.
- Результаты исследования дегидроксилации слюды в системе «слюда – стекло» могут служить основанием для выявления общих закономерностей в формировании композитов, включающих последовательно стадии: дегидратация, дегидроксилация с образованием дегидроксилата и разложение дегидроксилата с последующим взаимодействием продуктов разложения с компонентами стекла. Этот процесс можно представить так:
мусковит
дегидроксилация:
KAl3Si3O10(OH)2 > KAl3Si3O10•O + H2O
мусковит дегидроксилат вод. пар
разложение дегидроксилата:
KAl3Si3O10•O > KAlSi3O8 + Al2O3
дегидроксилат санидин оксид алюминия
флогопит
дегидроксилация:
KMg3AlSi3O10(OH)2 > KMg3AlSi3O10•O + H2O
флогопит дегидроксилат вод. пар
разложение дегидроксилата:
KMg3AlSi3O10•O > KAlSi3O8 + 3MgO
дегидроксилат санидин оксид магния



