Биоаккумуляция металлов бактериями может осуществляться, в частности, вследствие образования комплексов аминокислот и белков с атомами металлов, которые могут поглощаться бактериями по известным специальным механизмам транспорта [1, 3].
Большинство теоретических работ по исследованию процессов связывания металлов с аминокислотами и белками основаны на квантово-химических расчетах комплексов аминокислот с металлами [4, 6–8]. Это связано с тем, что белки являются громоздкими системами, расчеты комплексов белков затруднительны и требуют больших ресурсов ЭВМ. В свою очередь, аминокислоты, являясь структурными единицами белков, содержат в составе порядка двадцати атомов, что делает их удобными для квантово-химического моделирования. Однако представляет интерес исследование процессов образования комплексов металлов с аминокислотами в присутствии молекул воды, поскольку процессы аккумуляции металлов бактериями протекают в растворе.
В связи с этим целью работы является определение структуры и устойчивости комплексов атома цинка с двумя аминокислотами аланина при участии и без участия молекул воды; сравнение теоретических ИК-спектров поглощения аминокислот и металлокомплексов цинка с молекулами аланина с экспериментальными ИК-спектрами среды супернатанта без металлов и среды супернатанта после инкубации с бактериями аккумулировавших Zn.
В работе квантово-химическими методами проведено моделирование структуры комплексов цинка с двумя молекулами аланина без участия воды и в их присутствии; исследована реакция Zn + 2Ala + 2H2О>Zn(OH)2 + фрагменты. Рассчитаны и проанализированы ИК-спектры поглощения металлокомплексов цинка с аланином и экспериментальные ИК-спектры сред супернатанта.
Материалы и методы исследования
Оптимизация геометрических параметров равновесных состояний комплексов осуществлялась в рамках метода теории функционала плотности (DFT), с обменно-корреляционным функционалом B3LYP [10], на функциях неограниченного метода Хартри – Фока с базисом 6-31G(1p,1d) с учетом теории возмущений Меллера – Плессе (MP2) [8]. Оптимизация проводилась только для связей атомов кислорода и азота с атомом цинка и связей, ближайших к атомам кислорода и азота, остальные естественные переменные замораживались. Расчет и анализ профилей сечений поверхности потенциальной энергии (ППЭ) произведен по методу DFT с использованием B3LYP/6-31G(p,d) базиса. Расчет колебательных спектров отдельной молекулы аланина и комплексов двух молекул аланина с цинком проведен с помощью метода DFT с учетом энергетической поправки MP2. Все рассчитанные частоты ИК–спектров, полученные при использовании функционала B3LYP/6-31G(p,d), были умножены на множитель 0.9627 (scaling factor), а при использовании метода MP2/6-31G(p,d) – на 0.9377. Scaling factor выбран на основании данных статьи [6]. Все расчеты проведены в пакете программ FireFly 8.1. Экспериментальное определение ИК-спектров произведено с помощью ИК Фурье-спектрометра ФТ-10 (Россия). Получение спектров происходило в атмосфере воздуха.
Результаты исследования и их обсуждение
Рассчитанная структура комплексов 1[Ala-Zn-Ala]0 без молекул воды и в присутствии молекул воды приведена на рис. 1.
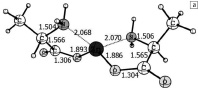
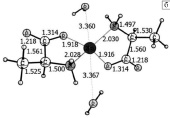
Рис. 1. Структура оптимизированных комплексов аланина с цинком: а – оптимизированное равновесное состояние комплекса 1[Ala-Zn-Ala]0 в отсутствии молекул воды, б – оптимизированное равновесное состояние комплекса 1[Ala-Zn-Ala]0с двумя молекулами воды
Согласно расчетам, атомы азота и кислорода координируются вокруг металла в виде тетраэдра, при этом расположение атомов азота и кислорода с противоположных сторон от атома цинка (L-аланин) менее выгодно по энергии. Разница между D-аланином, где с противоположных сторон от атома цинка находятся два атома азота или два атома кислорода, и L-аланином составляет 0,002 а.е.м. (0,054 эВ). В живых системах в большинстве случаев присутствует L-аланин, поэтому при проведении расчетов выбрана L-конфигурация.
Рассчитанные длины связей и углов в молекуле аланина хорошо согласуются с экспериментальными данными и результатами расчетов работ [2, 9, 11]. Компьютерное моделирование структуры комплекса 1[Ala-Zn-Ala]0 без молекул воды (рис. 1 а) приводит к результатам, согласующимся с результатами работ, где теоретически рассматриваются комплексы Val-Zn-Val, Gly-Zn-Gly, Ser-Zn-Ser [5, 13].
Определение устойчивости исследуемых комплексов проводилось на основе анализа рассчитанных трехмерных профилей сечений ППЭ (рис. 2) и вычисления энергии диссоциации (D0) связи Ala-Zn с участием двух молекул воды и без участия молекул воды. Можно заметить, что связи Zn-O и Zn-N в обоих комплексах весьма прочные, но вода стабилизирует комплекс и повышает его устойчивость. Энергия связи Zn-O в комплексе 1[Ala-Zn-Ala + 2H2O]0 составляет 3,15 эВ при расстоянии R(Zn-O) = 1,92 A. Энергия связи Zn-N в комплексе 1[Ala-Zn-Ala + 2H2O]0 составляет 3,41 эВ при расстоянии R(Zn-N) = 2,03 A (рис. 3).
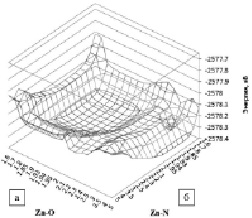
Рис. 2. Трехмерные профили сечений ППЭ вдоль связей Zn-Ala реакции взаимодействия Zn + 2Ala + 2Н2О: а – координата реакции Zn-O, б – координата реакции Zn-N
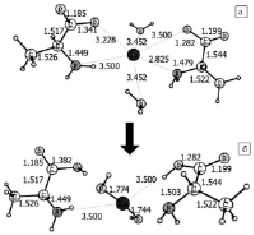
Рис. 3. Образование гидроксида цинка из метастабильного состояния с двумя молекулами воды, в котором цинк расположен на больших расстояниях от аминокислот: a – в начале реакции, б – в конце реакции
Известно, что аминокислоты в составе свободных белков и белков внутренних частей мембраны бактерий могут находиться на относительно большом (~5-6A) и малом (~3-4A) расстояниях [12]. Квантово-химический расчет показывает, что если металл расположен между двумя аминокислотами на относительно большом расстоянии, то в присутствии двух молекул воды происходит безбарьерная реакция, в которой образуется Zn(OH)2 + фрагменты (рис. 3).
Если же расстояние между молекулами аланина и атомом цинка относительно мало, то образуется комплекс, в котором обе молекулы воды входят в состав системы (рис. 1 б). По-видимому, такая структура комплекса и стереохимические затруднения не позволяют протекать реакции с образованием Zn(OH)2. Присутствие в среде супернатанта молекул гидроксида цинка может быть установлено и при исследовании ИК-спектров супернатанта после инкубирования бактерий с цинком на протяжении 36 часов по смещению и появлению новых комбинированных частот в области 600 и 800 см-1 с основным вкладом ν(ОН), ν(ZnO), δ(ZnOН), отсутствовавших в среде супернатанта без металла и в среде супернатанта на нулевой момент времени инкубации. Рассчитанные колебательные частоты ν(O-H), ν(Zn-O), δ(ZnOН) в изолированной молекуле гидроксида цинка и в комплексе 1[Ala-Zn-Ala-2H2O]0в присутствии молекул воды приведены в таблице.
Частоты валентных ν(O-H), ν(ZnO) и деформационных δ(ZnOН) колебаний, см-1, в ИК-спектрах поглощения в изолированной молекуле гидроксида цинка и в гидроксиде цинка, образованном в ходе реакции Zn2+ + 2Ala- + 2Н2О>Zn(OH)2 + 2Аla (частоты умножены на множитель 0.9627-scaling factor), расчет DFT/B3LYP/6-31(p,d)
|
Система |
Теоретический расчет |
|
|
Нейтральная (протонированная) форма аланина (рис. 3 б) 1[Ala-Zn(OH)2-Ala]0 |
1[Zn(OH)2]0 |
|
|
ν(O-H) |
3753.90, 3707.00 |
3747.33, 3704.60 |
|
ν(Zn-O) |
608,45(сим.) 785.76 (антисим.) |
661,9 (сим.) 831,92 (антисим.) |
|
δ(ZnOН) |
847.77, 683.38,717.22,758.39,792.58, 805.7, 828.08 |
780,94 767,82 |
Анализ теоретических ИК-спектров поглощения молекулы [Zn(OH)2] показывает, что частоты ν(ОН), практически совпадают с частотами ν(ОН), в комплексе 1[Zn + 2Ala + 2Н2О]0 (Δν ≈ 10 см-1), частоты ν(Zn-O) несколько сдвинуты в красную область, в то время как частоты деформационного колебания δ(ZnOН) в комплексе 1[Ala-Zn(OH)2-Ala]0 сдвинуты как в красную, так и в синюю область по сравнению с аналогичными колебаниями в 1[Zn(OH)2]0. При этом в комплексе 1[Ala-Н-Zn(OH)2-Ala-Н]0 появляются дополнительные пики, соответствующие комбинированным колебаниям, где основной вклад от δ(ZnOН) смешивается с валентными и деформационными колебаниями скелета молекулы аланина.
Сравнение ИК-спектров поглощения в комплексе 1[Ala-Zn-Ala + 2Н2О]0 с экспериментальным спектром ИК супернатанта после 36 часов культивирования бактерий B. licheniformis штамма ВКПМ В 7038 в жидкой среде в присутствии солей цинка, показывает (рис. 4), что пики на частотах 400–600 см-1 и в области 800 см-1 могут быть идентифицированы как частоты δ(ZnO), δ(ZnOН), характерные для гидроксида цинка Zn(OH)2.
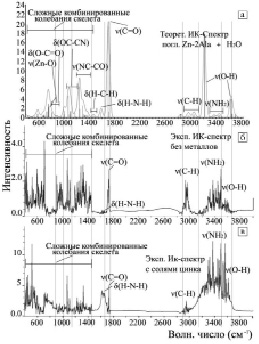
Рис. 4. Теоретический и экспериментальные ИК-спектры комплексов и различных сред супернатанта: а – теоретический спектр комплекса [Zn2+-Ala-2], б – спектр супернатанта после 36 ч культивирования с бактериями без металлов, в – спектр супернатанта после 36 ч культивирования с бактериями с цинком
В теоретическом расчете ИК-спектра комплекса 1[Ala-Zn-Ala]0 имеются слабые комбинированные частоты с наибольшим вкладом от колебаний Zn-N, Zn-O в области 400–600 см-1 в сочетании с крутильными колебаниями NH2, CH3, CH2. В области 600–700 см-1 наблюдается частота ν(NH2) = 636 см-1 крутильного колебания функциональной группы NH2, связанной с ионом цинка. Можно полагать, что в экспериментальных ИК-спектрах супернатанта после культивирования бактерий солями цинка полоса поглощения с волновым числом ν(NH2) = 657–669 см-1 можно также отнести к крутильному колебанию функциональной группы NH2. Необходимо отметить, что в теоретическом расчете ИК-спектра безметального бимолекулярного комплекса 1[Ala-Ala]0 пик крутильного колебания функциональной группы NH2 находится в области 200–300 см-1.
Выводы
В результате моделирования комплексов цинка с двумя молекулами аланина в присутствии молекул воды может реализоваться как безбарьерное образование системы [Zn(OH)2 + 2Аla], так и образование единого синглетного комплекса 1[Ala--Zn-Ala- + 2Н2О]0, где атом Zn расположен на близком расстоянии от аминокислот и вследствие стерических затруднений не может образоваться гидроксид цинка.
Сравнение ИК-спектров поглощения среды супернатанта до и после инкубации с бактериями, аккумулировавшими Zn, и теоретических ИК-спектров гидроксида цинка, комплекса 1[Ala--Zn-Ala- + 2Н2О]0 указывает на появление дополнительных пиков в полосе 600–800 см-1 в ИК-спектре среды супернатанта, связанных, предположительно, с колебаниями ν(ZnO), δ(ZnOН) в Zn(OH)2. Наряду с этими колебаниями нужно отметить сложные колебания, отнесенные к колебаниям углеродного скелета комплекса 1[Ala-Zn-Ala]0 и имеющие вклады от ν(ОН), ν(ZnO), δ(ZnOН), что подтверждает экспериментально установленную возможность образования в среде супернатанта гидроксида цинка Zn(OH)2 в процессе аккумуляции ими Zn бактериями B. licheniformis штамма ВКПМ В 7038.
Статья выполнена при поддержке гранта Оренбургской области в сфере научной и научно-технической деятельности № 17.



