Молибденсодержащие оксидные соединения щелочных металлов обладают с научной и прикладной точек зрения ценными физическими свойствами (сегнетоэлектрическими, магнитными, ионопроводящими и др. [1–3, 5, 8–10], поэтому весьма эффективно исследуются в последние десятилетия. К одной из таких групп соединений относятся цезийсодержащие тройные молибдаты. Синтез новых тройных молибдатов и всестороннее исследование их физических свойств способствуют выяснению природы и условий, благоприятствующих проявлению этих свойств. В настоящей работе приведены данные по фазообразованию в тройных солевых системах, содержащих цезий и трех-четырехвалентные элементы, получению и характеризации тройных молибдатов CsRM0,5(MoO4)3 (R = Al, Cr, In, Sc, Ga, V; M = Zr, Ti).
Материалы и методы исследования
Для синтеза в качестве исходных соединений в работе использовали: Cs2MoO4 («х.ч.»), Al2(MoO4)3 («х.ч.»), Zr(MoO4)2, полученный отжигом ZrO2 («х.ч.») и MoO3 («ч.д.а.») (400–750 °C, 100 ч), а также оксиды TiO2 (99,9 %) и Ga2O3 («х.ч.»). Молибдаты трехвалентных металлов R2(MoO4)3 (R = Cr, In, Sc) получали в результате отжига соответствующих оксидов (содержание основного компонента не менее 99,9 %) и нитратов («х.ч.») с триоксидом молибдена в течение 100–200 ч, при 350–800 °С. Однофазные керамические фазы тройных молибдатов были получены из соответствующих средних молибдатов и/или оксидов в интервале температур 350–700 °С. Фазообразование изучено методом «пересекающихся разрезов» в субсолидусной области. Фазовый состав и полноту синтеза проверяли при помощи рентгенофазового анализа на дифрактометре Advance D8 фирмы Bruker с использованием CuKa-излучения в геометрии Брэгга-Брентано c линейным детектором Vantec. С помощью программ FullProff с пакетом программ WinPLOTR [12] по монокристалльным данным изоструктурных соединений вычислены и уточнены кристаллографические характеристики. Дифференциальная сканирующая калориметрия (ДСК) проведена на термоанализаторе NETZSCH STA 449 C (Jupiter). Величина навески составляла 15–20 мг, скорость подъема температуры 10 К/мин. Образцом сравнения служил прокаленный Al2O3.
Результаты исследования и их обсуждение
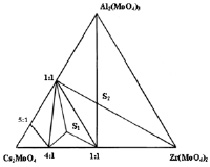
Результаты исследования систем Cs2MoO4–R2(MoO4)3–Zr(MoO4)2 (R = Al, Cr, Sc, In) в субсолидусной области 500–550 °C представлены на рис. 1, а–б [9, 10]. По характеру фазовых равновесий система с трёхвалентным элементом Al имеет отличие. Исследованные системы можно разделить на группы: 1 – Al; 2 – Cr, In, Sc. В системе Cs2MoO4–Al2(MoO4)3–Zr(MoO4)2 образуются две фазы Cs5AlZr(MoO4)6 (S1) и CsAlZr0,5(MoO4)3 (S2). В системе Cs2MoO4–R2(MoO4)3–Zr(MoO4)2 (R = Cr, Sc, In) также синтезированы тройные молибдаты Cs5RZr(MoO4)6 (S1) и CsRZr0,5(MoO4)3 (S2).
При исследовании фазовых равновесий в молибдатных системах установлено образование изоструктурного ряда молибдатов с мольным соотношением исходных компонентов 1:1:1 CsRZr0,5(MoO4)3 (R = трехвалентные элементы). Соединение данного состава получено со всеми трехвалентными элементами за исключением висмута. Изоструктурные тройные молибдаты с галлием получены из соответствующих оксидов галлия и молибдена со средними молибдатами. Тройной молибдат CsVZr0.5(MoO4)3 получен в условиях вакуума при температуре 550 °С.
При использовании в качестве четырёхвалентного катиона Ti получены керамические фазы состава CsRTi0,5(MoO4)3 (R = Al, Cr, Ga, Sc, In) [9, 10].
Синтезированы ряды тройных молибдатов с четырехвалентными катионами M = Zr, Ti состава CsRM0,5(MoO4)3 (R = Al, Cr, In, Sc, Ga, V). Оптимальные условия синтеза для CsRZr0,5(MoO4)3 – конечная температура синтеза 680–700 °С, время отжига t = 100 ч и CsRTi0,5(MoO4)3 – 580–600 °С (t = 150 ч). Химические реакции при синтезе соединений CsRZr0,5(MoO4)6 из стехиометрической смеси средних молибдатов протекают по схеме
Cs2MoO4 + R2(MoO4)3 + Zr(MoO4)2 > 2Cs(RZr0,5)(MoO4)3.
Для соединений CsRTi0,5(MoO4)3:
Cs2MoO4 + R2(MoO4)3 + TiO2 + 2MoO3 > 2Cs(RTi0,5)(MoO4)3.
 а
а 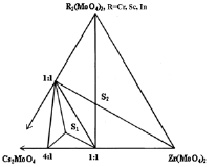 б
б
Рис. 1. Субсолидусное строение фазовых диаграмм систем: а – Cs2MoO4–Al2(MoO4)3–Zr(MoO4)2; б – Cs2MoO4–R2(MoO4)3–Zr(MoO4)2 (R = Cr, Sc, In) при 500–550 °C
Все полученные тройные молибдаты представляют собой поликристаллические вещества разнообразных оттенков, нерастворимые в воде и обычных органических растворителях (этиловый спирт, бензол, толуол, четыреххлористый углерод, ацетон). В концентрированных и разбавленных азотной и соляной кислотах растворяются при комнатной температуре.
Монокристалл тройного молибдата CsAlZr0,5(MoO4)6 получен методом раствор-расплавной кристаллизации [6]. Структура решена в пространственной группе 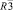 . Выявлено статистическое распределение атомов трехвалентного катиона и циркония по девятикратной (в
. Выявлено статистическое распределение атомов трехвалентного катиона и циркония по девятикратной (в  ) позиции M(1). Коэффициент заселенности позиции М(1) = 2/3R + 1/3Zr. Статистически-распределенные катионы трехвалентного элемента и циркония в позиции М(1) имеют октаэдрическую координацию по кислороду. Низкозарядные щелочные катионы цезия расположены внутри крупных полиэдров – 12-вершинников.
) позиции M(1). Коэффициент заселенности позиции М(1) = 2/3R + 1/3Zr. Статистически-распределенные катионы трехвалентного элемента и циркония в позиции М(1) имеют октаэдрическую координацию по кислороду. Низкозарядные щелочные катионы цезия расположены внутри крупных полиэдров – 12-вершинников.
Кристаллическая структура исследованного молибдата представляет собой трехмерный смешанный каркас, состоящий из последовательно чередующихся МоO4-тетраэдров и октаэдров MO6, соединяющихся друг с другом через общие О-вершины. Пространство, занимаемое двумя Cs-полиэдрами на близких расстояниях, можно рассматривать как единую полость, в которой каждый атом Cs имеет возможность занимать две расщепленные по оси z позиции. Основной особенностью структуры можно считать наличие вдоль оси 3 широких каналов, в которых размещаются катионы цезия (рис. 2). Следует отметить, что грани из 3 атомов кислорода не могут служить препятствием при перемещении атомов Cs вдоль канала, поскольку расстояние между ними превышает удвоенную сумму ионных радиусов Cs [11]. Следовательно, имеются структурные предпосылки ионопроводящих свойств в синтезированных соединениях.
Результаты структурного анализа соединения CsAlZr0,5(MoO4)3 положены в основу индицирования рентгенограмм изоструктурных соединений CsRZr0,5(MoO4)3 и CsRTi0,5(MoO4)3 (R – трехвалентные элементы).
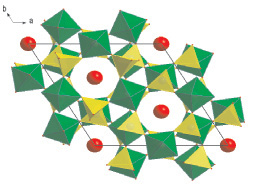
Рис. 2. Кристаллическая структура – проекция слоя на плоскость (001)
Таблица 1
Кристаллографические и термические характеристики соединений Cs(RZr0,5)(MoO4)3
|
Соединение |
Параметры элементарной ячейки |
Tпл, °С |
||
|
a, A |
c, A |
V, A3 |
||
|
CsAlZr0,5(MoO4)3 |
12,9441(2) |
12,0457(4) |
1747,86(7) |
800 |
|
CsCrZr0,5(MoO4)3 |
13,004(4) |
12,099(5) |
1771,96(4) |
805 |
|
CsGaZr0,5(MoO4)3 |
13,061(4) |
12,094(4) |
1786,73(9) |
810 |
|
CsVZr0,5(MoO4) |
13,116(9) |
12,185(3) |
1810,68(5) |
750 |
|
CsScZr0,5(MoO4) |
13,395(2) |
12,216(2) |
1898,12(4) |
850 |
|
CsInZr0,5(MoO4) |
13,427(4) |
12,247(5) |
1912,13(11) |
865 |
В табл. 1 представлены результаты индицирования рентгенограмм с использованием программы FullProf и термические характеристики тройных молибдатов. Температуры плавления полученных соединений определяли по данным ДСК и визуальной политермией. Все полученные тройные молибдаты плавятся инконгруэнтно.
Определены кристаллографические и термические характеристики синтезированных соединений состава CsRTi0,5(MoO4)3 (R = Al, Cr, Ga, Sc, In) (табл. 2). Показано соответствие между измеренной и вычисленной рентгенограммами на примере CsCrZr0,5(MoO4)3 и CsCrTi0,5(MoO4)3 (рис. 3 а, б). Соединения кристаллизуются в тригональной системе с пространственной группой 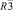 , Z = 6. Объем элементарной ячейки возрастает с увеличением ионного радиуса R трехвалентного элемента.
, Z = 6. Объем элементарной ячейки возрастает с увеличением ионного радиуса R трехвалентного элемента.
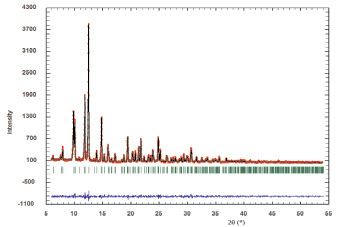
а
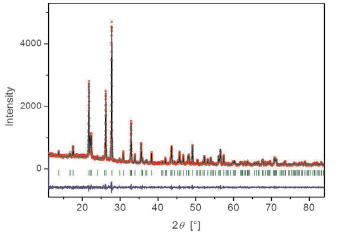
б
Рис. 3. Измеренные и вычисленные рентгенограммы тройных молибдатов: а – CsCrZr0,5(MoO4)3; б – CsCrTi0,5(MoO4)3
Таблица 2
Кристаллографические и термические характеристики соединений CsRTi0,5(MoO4)3
|
Соединение |
Параметры элементарной ячейки, A |
Tпл, °C |
|
CsAlTi0,5(MoO4)3 |
a = 12,6219(3) c = 11,7154(5) |
722 |
|
CsCrTi0,5(MoO4)3 |
a = 12,8340(1) c = 12,0056(1) |
741 |
|
CsGaTi0,5(MoO4)3 |
a = 12,8458(3) c = 12,0100(3) |
652 |
|
CsScTi0,5(MoO4)3 |
a = 13,1539(3) c = 12,1680(4) |
780 |
|
CsInTi0,5(MoO4)3 |
a = 13,2013(3) с = 12,2190(5) |
763 |
Заключение
Представлены результаты исследований молибдатных систем Cs2MoO4–R2(MoO4)3–Zr(MoO4)2 (R = Al, Cr, Sc, In). В исследованных системах установлено образование молибдатов формульного состава CsRZr0,5(MoO4)3. Методом твердофазных реакций на воздухе синтезированы ряды тройных молибдатов с четырехвалентными катионами M = Zr, Ti состава CsRM0,5(MoO4)3 (R = Al, Cr, In, Sc, Ga, V). Рентгенографически установлено, что образцы состоят из тригональной фазы, определены параметры и объем элементарной ячейки, температуры плавления синтезированных соединений. При увеличении ионного радиуса трехвалентного катиона в ряду соединений наблюдается увеличение температуры плавления и кристаллографических характеристик. Синтезированные цирконийсодержащие тройные молибдаты обладают более высокими температурами синтеза и плавления. Это свидетельствует о роли размерного фактора катионов в формировании структуры и свойств.




 , their characteristics depend on of the ionic radius of three-valent element.
, their characteristics depend on of the ionic radius of three-valent element.