Благодаря наблюдающемуся росту инновационных, биомедицинских и информационных технологий на сегодняшний день, офтальмология, как наука наиболее требовательная к уровню технического оснащения выходит на одно из первых мест среди наиболее интенсивно развивающихся отраслей медицины. Неуклонно растет и интерес к поиску новых подходов к разработке диагностического оборудования – внедряется новая аппаратура, в том числе и компьютерные технологии, создаются новые программно-аппаратные комплексы [4]. Соответственно возрастают требования к скрининговым методам диагностики, которые в свою очередь должны быть диагностически точными, малоинвазивными, экономически доступными, и простыми в применении. Наиболее подходящим в этом отношении является скрининговая программа на основе программно – аппаратного комплекса, разработанного учеными ДВО РАН [8]. Основное предназначение комплекса заключается в регистрации диффузной или глобальной магнитоэлектрической активности (ДМА) головного мозга, с ее последующим спектральным анализом и выявлением на основе полученных данных признаков дисфункций различных органов и систем организма человека, в том числе и зрительного анализатора [3]. По мнению разработчиков, основная доля ДМА связана с неспецифической активирующей системой мозга и восходящим потоком афферентации от фоновоактивных вегетативных рецепторов внутренних органов и систем. Тонус интерорецепторов при различных патологических состояниях организма находит прямое отражение в определенных частотных спектрах индукционной магнитэнцефалорафии (МЭГИ), что подтверждено многочисленными теоретическими и экспериментальными работами [3, 6, 1]. В предыдущих работах мы рассматривали возможность выявления признаков различных ишемических заболеваний зрительного нерва и сетчатки, а так же глаукомы при помощи МЭГИ [2]. Учитывая принципиальное сходство МЭГИ и электроэнцефалографии (ЭЭГ), мы предприняли попытку сравнить показатели данных методов, используя единый способ программно-аппаратной обработки данных.
Цель работы – выявить закономерные сходства и различия показателей МЭГИ и ЭЭГ у пациентов с хронической формой передней ишемической оптической нейропатиии (ПИОН) и первичной открытоугольной глаукомой (ПОУГ)
Материалы и методы исследования
В исследование были включены пациенты, проходящие курс лечения в глазном отделении Приморской краевой клинической больницы № 2 г. Владивостока, после подписания информированного согласия (Этическая экспертиза № 4, дело № 32 от «16» февраля 2009 г., ГБОУ ВПО «Владивостокский государственный медицинский университет»).
В первую группу исследуемых было включено 68 пациентов (24 мужчины, 44 женщины) с хронической ПИОН в возрасте 55 ± 7 лет.
Вторая группа состояла из 45 человек (25 мужчин, 20 женщины) с І–ІІ стадией ПОУГ в возрасте от 49 до 70 лет. Регистрация и спектральный анализ ДМА головного мозга проводился при помощи магнитоэнцефалографа индукционного «МЭГИ-01» (Патент № 72395; Заявка № 2007145888; Приоритет от 3 декабря 2007 г.), разработанного на базе лаборатории экологической нейрокибернетики научно-исследовательского центра «Арктика» Дальневосточного отделения РАН и являющегося оригинальным прибором. МЭГИ имеет двухканальную систему отведения – соответственно левому и правому полушарию с установкой индукционных катушек в лобных отведениях. Диаметр катушек – 50 мм, расстояние между центрами катушек – 80 мм. Чувствительность усилителей – 2 пТл/мм, частотный диапазон 0,1–30 Гц. Уровень шума в полосе частот не более 1 мкв. Число полосовых фильтров при спектральном анализе – 840. Время одного обследования (суммации) – 160 с. Число съемов одного пациента – не менее трех.
Параллельно, для регистрации биопотенциалов был применен электроэнцефалограф «Нейрон спектр 1». Как и при МЭГИ исследовании, использовалось двухканальное отведение в проекции лобных долей мозга. Принципиальной разницей при исследовании данными методами было применение индукционных катушек, не контактирующих с поверхностью скальпа и регистрирующих в основном магнитную составляющую биопотенциалов при МЭГИ – исследовании и кожных электродов, устанавливающихся на поверхность скальпа и регистрирующих преимущественно электрическую составляющую.
Данные ЭЭГ и МЭГИ подвергались программно-аппаратному анализу с использованием единого программного обеспечения, и представлялись в виде графиков, отображающих спектральную оценку в различных частотных диапазонах, соответствующих определенной группе вегетативных рецепторов. Спектральная оценка выражалась в относительных единицах по шкале ординат от 1 до 10. Шкала абсцисс отображала частотные диапазоны соответствующих определенному типу вегетативных рецепторов (F1–F7). Каждый график представлялся для определенной сегментарной области, отражающих спинномозговые рефлекторные вегетативные центры, в которых регистрировалась афферентная активность ВНС в соответствии с сегментарным строением спинного мозга. Шейные сегменты – С1–С8, грудные – Th1–Th12, поясничные – L1–L5, крестцовые – S1–S5, К (рис. 1).
Полученные результаты обрабатывались на персональном компьютере IBM PC, с использованием пакета прикладных программ Statistica 6,0 (Реброва О.Ю., 2003). Сравнение двух независимых групп проводилось по качественным признакам с использованием критерия «Хи» – квадрат (χ²). Количественные данные обрабатывались при помощи непараметрического теста Вальда – Вольфовица и Колмогорова – Смирнова. Статистически значимыми считались различия, при которых коэффициент доверительной вероятности (p) был ниже 0,05. Так же для сравнения показателей ЭЭГ и МЭГИ был применен корреляционный анализ Спирмена. Учитывая отличие распределения признаков от нормального, в качестве описательной использованы такие показатели, как среднее (M), медиана (Me), и интерквартильный размах – 25 (P25 %) и 75 (P75 %) процентили.
Результаты исследования и их обсуждение
В первой группе исследуемых с хронической ПИОН отмечено наличие десинхронизации функции F2-4 сегментарной области Th1 как при МЭГИ (p = 0,0153), так и ЭЭГ (p = 0,0162) исследовании, с преимущественным снижением амплитуды спектральной оценки левого полушария (p = 0,0125) (рис. 1). Статистические выборочные показатели представлены в табл. 1.
Функция F2-4 соответствует частотному спектру 7,288 Гц и отвечает за тонус «альфа1» адренорецепторов артериальных сосудов [7]. Сегментарный центр, в системе частотных координат в котором была выявлена нами данная закономерность, находился в соответствии с сегментарным представительством симпатической иннервации глаза и зрительного нерва и приходился на область Th1. С позиции исследователей данный фактор можно косвенно расценить как преобладание симпатического тонуса с явлениями раздражения «альфа1» адренорецепторов артериальных сосудов питающих зрительный нерв. Однако данное предположение требует более детальных исследований.
Еще одна закономерность, выявленная нами в данной группе, заключалась в преобладании медленной биоэлектрической активности в виде синхронного повышения амплитуды спектральной оценки правого и левого полушарий функции F7-4 сегментарного центра Th1, что соответствует частоте 0,227 Гц (рис. 1). При проведении корреляционного анализа, данные ЭЭГ И МЭГИ имели тесную прямую зависимость, что указывает на равнозначность полученных результатов (табл. 1).
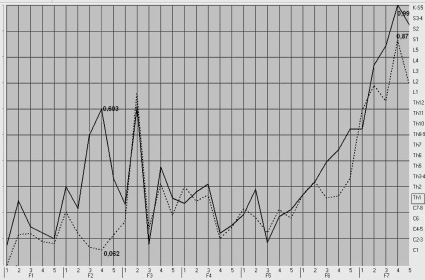
Рис. 1. График спектральной оценки МЭГИ. Сегментарная область Th1. Непрерывная линия – правое полушарие; пунктирная – левое. Указаны значения спектральной оценки в относительных единицах. По оси абсцисс частотные спектры (функции F1-F7); по оси одинат сегментарные центры от C1 до S5
Таблица 1
Значения показателей спектральной оценки 1 группы при ЭЭГ и МЭГИ исследовании и их корреляционная зависимость в относительных единицах, M; Me [P25 %; P75 %]
|
Метод исследования |
Критерии |
||
|
F2-4 разность амплитуд |
F7-4 амплитуда п.п. |
F7-4 амплитуда л.п. |
|
|
ЭЭГ |
0,28; 0,18[0,06; 0,36] |
0,91; 0,69[0,36; 1,32] |
0,92; 0,77[0,35; 1,32] |
|
МЭГИ |
0,26; 0,15[0,05; 0,36] |
0,97; 0,73[0,38; 1,4] |
0,98; 0,82[0,38; 1,44] |
|
Rs (p) |
0,96 (p < 0,01) |
0,97 (p < 0,01) |
0,98 (p < 0,01) |
Примечания: Rs – коэффициент Cпирмена; p – коэффициент доверительной вероятности; M – среднее; Me – медиана; P25 % – 25 процентиль; P75 % – 75 процентиль.
Учитывая данные литературных источников [5], повышение спектральной мощности медленных электрических процессов (МЭП) и в частности секундного и декасекундного диапазонов в нервной ткани отражает возникновение функционального и метаболического напряжения в нейронно-глиальном взаимоотношении. Существенным фактором представляется отчетливая тенденция многих исследователей в той или иной степени связывать генез МЭП с процессами метаболизма в головном мозге, а так же в зрительных нервах или интерпретировать двойственность их происхождения, указывая на тесную связь, с одной стороны, с процессами метаболизма, с другой – с активностью нейронов [9]. Основываясь на данные факты, мы можем предполагать, что наличие повышения уровня спектральной оценки в частотном диапазоне МЭП у исследуемых с хронической ПИОН может указывать именно на наличие метаболических расстройств, а так же на уровень нейродегенеративных процессов в зрительных нервах.
У пациентов 2 группы с ПОУГ статистически значимой закономерностью по данным МЭГИ и ЭЭГ явилось повышение амплитуды огибающей спектр правого полушария функции F1-3 сегментарного центра С7-8 (p = 0,012), что соответствовало частотам 15,0–14,7 Гц, снижение амплитуды функции F6-2 в сегментарной области С7-8 (0,76–0,39 Гц) (p = 0,234), а так же резкий перепад (градиент) функции при переходе F3-3 в F3-4, наиболее выраженный в сегментарном центре С7-8, что соответствует частотам 4,7–1,5 Гц (p = 0,022).
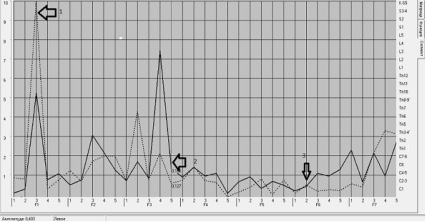
Рис. 2. График спектральной оценки МЭГИ. Сегментарная область С7-8. Непрерывная линия – правое полушарие; пунктирная – левое. Указаны значения спектральной оценки в относительных единицах. По оси абсцисс частотные спектры (функции F1-F7); по оси ординат сегментарные центры от C1 до S5. Стрелками указаны признаки глаукомного процесса
Сравнительная характеристика полученных данных при помощи МЭГИ и ЭЭГ, а так же коэффициенты корреляции представлены в табл. 2.
Таблица 2
Значения показателей спектральной оценки 2 группы при ЭЭГ и МЭГИ исследовании и их корреляционная зависимость в относительных единицах, M; Me [P25 %; P75 %]
|
Метод исследования |
Критерии |
||
|
F1-3 амплитуда п.п. |
F3-3 – F3-4 градиент п.п. |
F6-2 амплитуда п.п. |
|
|
ЭЭГ |
0,83; 0,69 [0,34; 1,11] |
0,59; 0,41 [0,31; 0,88] |
0,12; 0,11 [0,08; 0,17] |
|
МЭГИ |
0,87; 0,67 [0,41; 1,12] |
0,62; 0,51 [0,29; 0,99] |
0,13; 0,12 [0,09; 0,17] |
|
Rs (p) |
0,89 (p < 0,01) |
0,96 (p < 0,01) |
0,86(p < 0,01) |
Примечания: Rs – коэффициент Cпирмена; p – коэффициент доверительной вероятности; M – среднее; Me – медиана; P25 % – 25 процентиль; P75 % – 75 процентиль.
Как видно, по данным таблицы, выявленные признаки по данным ЭЭГ и МЭГИ имеют прямую очень тесную корреляционную зависимость, следовательно, показатели данных методов фактически равнозначные.
Экспериментальными исследованиями доказано, что частотный диапазон функции F1-3 отражает центральное звено «альфа2» – адренорецепторов гладкой мускулатуры, в связи с чем, мы можем предположить, что в данном случае имеет место повышение тонуса цилиарной мышцы глаза, гладкая мускулатура которой содержит такие рецепторы, что в принципе не противоречит патогенезу глаукомного процесса. Выявленный градиент при переходе функции F3-3 в F3-4, может свидетельствовать о нарушении венозного оттока из глаза, так как указанные функции отражают тонус венозного и лимфатического коллекторов. Снижение амплитуды функции F6-2 рассматривается, как угнетение парасимпатической составляющей ВНС и в частности М-холинорецептров.
Выводы
1. Данные МЭГИ и ЭЭГ пациентов с хронической формой ПИОН, а так же с глаукомой достоверно отличаются от данных практически здоровых исследуемых.
2. Анализ данных пациентов с хронической ПИОН позволяет предположить наличие изменений центральных звеньев вегетативной нервной системы с преобладанием симпатического тонуса в частотном спектре «альфа 1» адренорецепторов артериальных сосудов. Выявлено достоверное повышение спектральной оценки МЭП у пациентов с хронической ПИОН и по данным МЭГИ и ЭЭГ.
3. У больных с ПОУГ наблюдались признаки изменения центральных частот, свойственных «альфа 2» адренорецепторам гладкой мускулатуры, наряду с ослаблением парасимпатического звена ВНС, а так же ослабление тонуса венозного коллектора по данным ЭЭГ и МЭГИ.
4. На основании корреляционного анализа выявлено практически полное сходство полученных спектрограмм, как при использовании индукционных катушек, так и кожных электродов с учетом использования единого программного обеспечения для обработки данных.



