Одной из важных проблем современной онкологии является лечение рака легкого, так как в последнее время наблюдается резкое нарастание заболеваемости и смертности от этого заболевания в большинстве промышленно развитых стран. В настоящее время рак легкого прочно занял лидирующие позиции в структуре онкологической заболеваемости населения планеты. Наряду с ростом заболеваемости отмечено увеличение частоты смертности при раке данной локализации [4]. Ежегодно от рака легкого в мире умирает около 1 миллиона человек [8].
Основным методом лечения рака легкого остается хирургический, который является методом выбора при I - II стадиях заболевания, но у 60 - 70 % больных диагностируется III стадия процесса, когда чисто хирургическое лечение носит условно-радикальный характер.
В связи с этим разработка новых и усовершенствование уже имеющихся методов комбинированного лечения злокачественных новообразований является одной из актуальнейших проблем современной онкологии. Сочетание хирургического лечения с лучевой терапией позволяет существенно улучшить отдаленные результаты лечения рака легкого [9,10].
В последнее время при раке легкого используется метод интраоперационной лучевой терапии (ИОЛТ), позволяющий подвести эффективную однократную дозу облучения непосредственно на зоны регио-нарного метастазирования [5]. Совершенствование метода интраоперационной лучевой терапии может быть связано с увеличением разовой дозы облучения. Однако это неизбежно приведет к увеличению числа послеоперационных осложнений и летальности, что полностью будет нивелировать положительный эффект высокой однократной дозы облучения. Экспериментальными работами было показано, что оптимальной однократной дозой облучения при раке легкого является 15 - 20 Гр., так как более высокие дозы облучения вызывают необратимые патоморфологические изменения в тканях легкого и органах средостения [11].
Более перспективным подходом повышения эффективности лучевой терапии является исполь-зование радиосенсибилизаторов. Этот вопрос обсуждается на протяжении многих лет и в настоящее время сформулирован как проблема управления радиочувствительностью или более точно - управление тканевыми реакциями на облучение.
С точки зрения клинической радиобиологии, радиосенсибилизация вне зависимости от действия модифицирующего агента (до или после облучения), а также от наличия или отсутствия его собственного цитотоксического эффекта вызывает усиление действия лучевой терапии [3].
По мере изучения препаратов платины выяснилось многообразие механизмов их действия: кроме непосредственного токсического влияния на опухоль они ингибируют репарацию суб - и потенциально летальных лучевых повреждений, тем самым, повышая степень резорбции опухоли, при чем для этого необходимы дозы значительно меньшие, чем терапевтические [1].
Установлено, что комплексы платины проникают в ядро опухолевой клетки и ингибируют синтез ДНК, в основном за счет внутринитчатого сшивания ДНК. При облучении ионизирующим излучением фрагмента ДНК, содержащего атом платины, наблюдается расщепление ДНК в местах локализации атома платины. Разрыв цепей ДНК связан с селективным поглощением ионизирующего излучения атомами платины. Как известно, ионизирующее излучение поглощается веществом в результате фотоэффекта на внутренних оболочках атомов, входящих в состав молекул вещества. Вероятность захвата фотонов атомами платины в 20- 200 (в случае резонансного поглощения на L- уровне) раз превышает вероятность захвата атомами H, C, N, O, P. Следовательно, практически вся поглощенная молекулой энергия фотона выделяется на атоме платины. В результате фотоэффекта атом платины переходит в высоко-энергетическое состояние с "дыркой" на L-уровне. Заполнение этого уровня сопровождается эмиссией нескольких оже-электронов с внешних орбиталей атома платины и приводит к образованию много-зарядного положительного иона Ptn+. Локальный радиолиз оже-электронами и реакции нейтрализации положительного заряда приводят в конечном итоге к разрыву, повреждению 2- й спирали ДНК и, как результат, к гибели опухолевой клетки [2].
Реализация радиосенсибилизирующего эффекта цисплатина на прямую зависит от концентрации препарата в опухолевой ткани в зоне облучения в момент ИОЛТ, что обеспечивает усиление повреждающего действия лучевой терапии на опухолевые клетки без существенного воздействия на нормальные.
Целью данного исследования являлось инверсиионно-вольтамперометрическое изучение степени накопления платины, вводимой в виде препарата цисплатин в качестве радиосенсибилизатора, в биологических тканях у больных раком легкого во время сеанса интраоперационного облучения.
Цисплатин вводился по разработанной нами схеме внутривенно капельно 3-х кратно: ежедневно за 2 дня до операции и в день операции за 2 часа до облучения в дозе 6 мг/м2. Выполнялась радикальная операция (в объеме пневмонэктомии или лобэктомии) и ИОЛТ в разовой очаговой дозе 15 Гр на зоны регионарного метастазирования. При пневмонэктомии в зону облучения включались: трахеобронхиальный угол, зона нижних бифуркационных лимфоузлов, паратрахеальная и паравенозная клетчатка. В случае удаления доли легкого в зону облучения дополнительно включалась прикорневая часть оставшейся доли с находящимися в ней бронхопульмональными лимфоузлами при верхней лобэктомии и ретроперикардиальная зона при локализации опухоли в нижней доле. Забор исследуемых биологических тканей проводился непосредственно после ИОЛТ.
Объектами исследования служили образцы опухоли, регионарных лимфатических узлов, периферической крови и легочной ткани у больных раком легкого III стадии.
Инверсионно-вольтамперометрическое исследование образцов на содержание платины проводили с использованием вольтамперометрического анализатора СТА (ООО "ИТМ" г. Томск) в комплекте с IBM. Для анализа использовали трехэлектродную ячейку, в которой рабочий электрод представляет собой импрегнированный полиэтиленом ртутно-графитовый электрод (РГЭ), работающий в режиме "in situ". Электродом сравнения служил насыщенный хлорид-серебряный электрод, вспомогательным - графитовый стержень диаметром 0.2-0.5 см. Все измерения проводили в фоне 1 М HCI, который готовили разбавлением 6 М HCI бидистиллятом. Основные растворы, используемые для оценки содержания платины в пробе, готовили в 3 М HCI из стандартных образцов платины. Стандартный раствор ртути (II) c концентрацией 1.3 мг/л готовили из соли Hg(NO3)2·H2O.
Известно, что инверсионно-вольтамперометрическое определение платины в хлоридных растворах на графитовом электроде возможно только при электроосаждении осадка в присутствии постороннего металла [6,7]. Поэтому электроконцентрирование платины на поверхность графитового электрода осуществляли при потенциале электролиза Е = - 0.8 В совместно с электроконцентрированием ртути. Время накопления варьировалось в зависимости от содержания платины (IV) в анализируемой пробе.
На рис. 1. представлена анодная инверсионная вольтамперограмма электроокисления осадка платина-ртуть с поверхности РГЭ. Пик при Е = + 0.15 В соответствует процессу окисления фазовой ртути с поверхности графитового электрода, а величина пика при Е = + 0.35 В пропорциональна концентрации платины (IV) в анализируемом растворе.
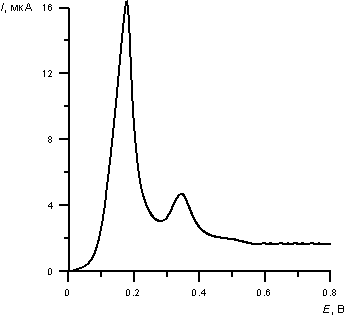
Рис. 1. Вольтамперная кривая электроокисления осадка Pt-Hg с поверхности РГЭ.
Потенциал электролиза Еэ = - 0.8 В. Время накопления 120 с. СPt=0.08 мг/л
Для инверсионно-вольтамперометрического определения платины необходимо перевести анализируемый образец в раствор. Для этого навеску анализируемой пробы высушивали до постоянной массы. Затем пробу обрабатывали 3.0 мл перегнанной HNO3. Повторную обработку пробы проводили смесью 2.0 мл HNO3 и 1.0 H2O2. Раствор выпаривали при 80 0С досуха, после чего пробу прокаливали в муфеле при Т ≈ 300 0С. Обрабатывали пробу H2O2 до полного удаления угольных включений. Если зола была неоднородна, повторно обрабатывали смесью HNO3 и H2O2. В случае ее однородности, осадок охлаждали до комнатной температуры, растворяли в 2.0 мл смеси HNO3 и H2O2 (1:3), выпаривали, обрабатывали перегнанной HCI при нагревании до 70 - 80 0С и выпаривали до влажных солей. Из подготовленного по такой методике образца платина переходит в форму PtCI62-, идентичную форме нахождения платины в стандартном растворе.
Приготовленную пробу перед анализом разбавляли до 10 мл раствором 1 М HCI. Из полученного минерализата для определения платины отбирали аликвоту, объемом 1.0-3.0 мл.
Концентрацию платины (IV) в анализируемом объекте определяли методом стандартных добавок (Рис. 2).
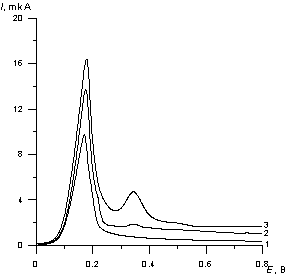
Рис. 2. Пример вольтамперограммы холостого определения (1), пробы (2) и добавки (3).
Потенциал электролиза Еэ = - 0.8 В. Время накопления 120 с.
Анализ объектов исследования показал, что при внутривенном введении цисплатина наибольшая концентрация содержалась в опухолевой ткани (29.9 ± 0.081 мг/кг), затем в регионарных лимфатических узлах (3.7 ± 0.247 мг/кг) и наименьшее количество в легочной ткани (1.7 ± 0.117 мг/кг) и периферической крови (0.8 ± 0.086 мг/кг).
Высокая концентрация цисплатина в первичной опухоли и лимфатических узлах, которые так же поражены опухолевым процессом, объясняется тропностью данного препарата к опухолевым клеткам, в отличие от здоровых тканей (легочной паренхимы) и крови, минимальная концентрация платины в которой обусловлена особенностями фармакокинетики цисплатина в организме больного в момент проведения сеанса ИОЛТ.
Полученные результаты содержания платины позволяют подтвердить предположение о правильности разработанной схемы внутривенного введения цисплатина, которая обеспечивает адресное поступление радиосенсибилизатора в опухоль и позволяет добиться максимального насыщения препаратом опухолевых клеток, в сравнении с легочной тканью и кровью. Это позволяет усилить лучевое воздействие интраоперационной лучевой терапии на зоны регионарного метастазирования, и таким образом улучшить результаты комбинированного лечения за счет сокращения количества локорегионарных рецидивов и увеличения продолжительности безрецидивного периода.
Литература
- Антипов С. А. Применение цисплатина с интраоперационным облучением в комбинированном лечении рака желудка: Автореф. дис. канд. мед. наук.- Томск, 2000.- 26 с.
- Гроховский С. Л., Зубарев В. Е. Специфическое расщепление 2-х спиральной ДНК, индуцированное ионизацией атома платины рентгеновским облучением // Доклады Академии наук СССР.- 1990.- Т. 313.- № 6. С. 1500- 1504.
- Дарьялова С. Л. и др. Использование противоопухолевых препаратов в качестве модификаторов реакции злокачественных опухолей на лучевую терапию // Современные тенденции развития лекарственной терапии опухолей. М., 1998.- С. 76.
- Двойрин В. В., Аксель Е. М., Герасименко В. Н. Состояние онкологической помощи населению России и некоторых других стран СНГ в 1993 году // М., ОНЦ РАМН.- 1994.- 126 с.
- Зырянов Б. Н., Афанасьев С. Г., Завьялов А. А., Мусабаева Л. И. Интраоперационная лучевая терапия.-Томск: Изд-во STT,- 1999.- 277 с.
- Колпакова Н.А., Немова Н.Н., Стромберг А.Г. // Журн. анал. химии. 1971. Т.26. №6. С.1217.
- Колпакова Н.А., Шифрис Б.С., Швец Л.А., Кропоткина С.В. // Журн. анал. химии. 1991. Т.46. №10. С.1910.
- Отчет о состоянии здравоохранения в мире. 1995 год: ликвидация разрывов // Всемирный форум здравоохранения. ВОЗ.- Женева.- 1995.- Т. 16.- № 4.- С. 44- 54.
- Харченко В. П., Чхиквадзе В. Д., Галил-Оглы Г. А. и др. Рак легкого: 30- летний опыт хирургического и комбинированного лечения. // Вопросы онкологии.- 1999.- Т. 45.- № 1.- С. 72- 76.
- Харченко В. П., Чхиквадзе В. Д., Галил-Оглы Г. А. и др. Лечение рака легкого. // Вопросы онкологии.- 1999.- Т. 45.- № 2.- С. 184- 187.
- de Boer W.J., Mehta D.M., Hoekstra H.J. The short and long term effects of intraoperative electron beam radiotherapy (IORT) on thoracic organs after pneumonectomy an experimental study in the canine model. // Int J Radiat Oncol Biol Phys, 1999, Sep 1, р. 501.



