Матка имеет сложную систему регуляции, которая включает филогенетически древние и молодые механизмы управления процессов морфогенеза и функциональной активности. Эффективность первых из них во многом определяется тучными клетками, одним из важнейших структурных компонентов которых являются гранулы с моноаминами. Биогенные амины, обладающие широким спектром биологических эффектов [3], представляют собой важное звено в системе нейрогуморальной регуляции функций матки [1, 7]. В то же время отсутствуют данные о динамике биоаминов в тучных клетках эндометрия в различные фазы полового цикла.
Цель работы: дифференцировать и определить содержание катехоламинов, серотонина и гистамина в тучных клетках эндометрия тела и шейки матки крыс в процессе полового цикла
Материал и методы исследования
Работа выполнена на 120 интактных самках крыс репродуктивного возраста в осенне-зимний период, которые были распределены на группы по стадиям полового цикла: ранний эструс, поздний эструс, метаэструс, ранний диэструс, поздний диэструс, проэструс. Животных выводили из опыта в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (приказ Минвуза от 13.11.1984 г № 724). Срезы тела матки толщиной 20 мкм изготавливались на криостате.
Методы исследования: флуоресцентно - гистохимические методы Фалька-Хилларпа в модификации для выявления катехоламинов и серотонина, метод Кросса-Эвана-Роста для дифференцировки гистамина [3, 4]; окраска альциановым синим-сафранином в прописи Дезаго [3].
Концентрацию биоаминов определяли в условных единицах шкалы регистратора с помощью люминесцентного микроскопа ЛЮМАМ-И3 с фотометрической насадкой ФМЭЛ-1А. Методом точечного счета и линейного интегрирования определялось количество флуоресцирующих тучных клеток (ТФ) и количество клеток, окрашенных в прописи Дезаго (ТО), на стандартную площадь [2]. Статистический компьютерный анализ осуществляли с помощью электронных таблиц Excel. Достоверность различий при сравнении величин определялась с помощью критерия Стьюдента. Для выявления и анализа сопряжений изменения параметров в динамике полового цикла применялись линейный корреляционный анализ Пирсона (r) и ранговый корреляционный анализ Спирмена (R). Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты исследования и их обсуждение
Тучные клетки эндометрия матки, которые не загружены гепарином (по результатам окраски в прописи Дезаго), имеют флуоресцирующую зеленовато-желтым цветом зернистость. Располагаются они преимущественно поодиночке. Некоторые тканевые базофилы обнаруживаются под эпителием или непосредственно в нем, единичные - в составе содержимого просвета матки. Наибольшее количество флуоресцирующих тучных клеток в слизистой оболочке тела матки наблюдается в поздний диэструс, в шейке - в проэструс. Минимум этого показателя в обеих исследуемых частях матки отмечается в метаэструс.
Микроспектрофлуориметрически в тучных клетках нами дифференцированы серотонин, гистамин и катехоламины. Полученные результаты подтверждают немногочисленные литературные данные о наличии в тучных клетках матки гистамина [5] и серотонина [6, 10]. Сведений о присутствии катехоламинов в тканевых базофилах матки нам не удалось найти.
В теле матки наименьшие концентрации серотонина и катехоламинов отмечаются в стадии раннего и позднего эструса, в шейке - в стадию метаэструса (рис. 1). Максимальное содержание указанных моноаминов в тканевых базофилах слизистой оболочки обеих исследуемых частей матки выявлено в стадию проэструса. В эту же стадию отмечается наибольший уровень гистамина в тканевых базофилах эндометрия тела матки. В шейке матки максимум этого показателя приходится на ранний эструс, минимум его в обоих регионах - на метаэструс.
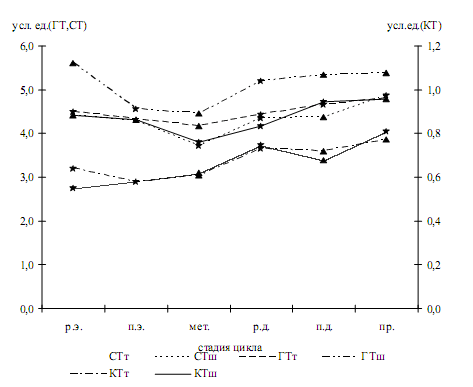
Рис. 1. Динамика содержания биоаминов в тучных клетках эндометрия тела (т) и шейки (ш) матки крыс в течение полового цикла (р.э. - ранний эструс, п.э. - поздний эструс, мет. - метаэструс, р.д. - ранний диэструс, п.д. - поздний диэструс, пр. - проэструс, КТ - катехоламины, СТ - серотонин, ГТ - гистамин)
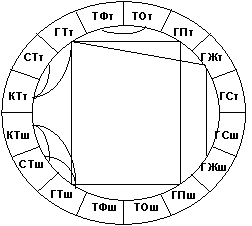
Статистический анализ демонстрирует достоверно более высокие показатели содержания исследуемых моноаминов в тучных клетках шейки матки по сравнению с ее телом в течение полового цикла. По данным рангового корреляционного анализа изменения уровня гистамина в тучных клетках слизистой оболочки тела и шейки матки характеризуются высокой степенью положительного хроносопряжения в течение полового цикла (рис. 2).
тело матки
шейка матки
Рис. 2. Схема ранговых корреляционных связей параметров оценки биоаминпозитивных структур эндометрия тела (т) и шейки (ш) матки крыс в течение полового цикла (КТ - содержание катехоламинов в тучных клетках, СТ - содержание серотонина в тучных клетках, ГТ - содержание гистамина в тучных клетках, ТФ - количество флуоресцирующих тучных клеток, ТО - количество тучных клеток, выявляемых по прописи Дезаго, ГП - содержание гистамина в покровных эпителиоцитах, ГЖ - содержание гистамина в железистых эпителиоцитах, ГС - содержание гистамина в содержимом просвета матки.)
Общепризнанным является положеие, что тканевые базофилы служат посредниками между нервной и гуморальной системами организма с одной стороны и «рабочими» клетками органов с другой, осуществляя гомеостатическую функцию по отношению к биогенным аминам [3]. Нами установлено, что на протяжении всего полового цикла сохраняется высокая степень тесноты положительной линейной связи между количеством серотонина и катехоламинов в тканевых базофилах эндометрия по точкам зондирования (r = 0,89-0,98). Этот факт свидетельствует о стремлении к сбалансированности гистогенетических процессов в слизистой оболочки матки в течение полового цикла. Дисбаланс концентраций моноаминов может быть одной из причин патологии эндометрия.
Расположение тканевых базофилов под эпителиями определяет их роль в морфогенетических процессах в этих тканях, как в норме, так и при патологии [8]. В настоящее время установлено, что гистамин участвует в стимулированной эстрогенами пролиферации эпителиоцитов эндометрия [4]. Предполагается участие тканевых базофилов в реализации действия эстрогенов на эпителий матки [5]. По данным рангового корреляционного анализа нами установлена высокая степень положительного хроносопряжения динамики изменений содержания гистамина в тканевых базофилах и клетках железистого и покровного эпителия эндометрия тела и шейки матки (рис. 2). Вероятно, тучные клетки являются одним из основных источников гистамина в эндометрии. Имеются данные, что и эпителиоциты эндометрия могут секретировать этот моноамин [11].
Таким образом, выделяя в межклеточное вещество и поглощая из него невостребованные «рабочими» клетками биогенные амины, транспортируя и инактивируя их, тучные клетки выступают в качестве регулятора биоаминового обмена в эндометрии. В результате они адаптируют фон биоаминового окружения эффекторных структур матки к конкретной рабочей ситуации, связанной с половым циклом.
СПИСОК ЛИТЕРАТУРЫ:
- Абрамченко В.В., Капленко О.В. Адренергические средства в акушерской практике. СПб., ТОО ТК «Петрополис», 2000. 272 с.
- Виноградов С.Ю. //Архив анатомии. 1984. Т. 87. № 8. С. 74.
- Гордон Д.С., Сергеева В.Е., Зеленова И.Г. Нейромедиаторы лимфоидных органов. Л.: Наука, 1982. 128 с.
- Gunin A. //European J. of Obstetrics & Gynecology and Reproductive Biology. 1995. Vol. 60. P. 69.
- Gunin A.G., Sharov A.A. //Journal of Reproduction and Fertility. 1998. 113. P.61.
- Horiuchi A., Nikaido T., Ya-Li Z. et al. //Mol. Hum. Reprod. 1999. Vol.5. №2. P.139.
- Martins E.Jr., Ferreira A.C., Skorupa A.L. et al. //J. Leukoc. Biol. 2004. V. 75. №6. P. 1116.
- Mori A., Zhai Y.L., Toki T. et al. //Hum. Reprod. 1997. V. 12. № 2. P. 368.
- Nakano K., Takamatsu S. //Nippon Yakurigaku Zasshi. 2001. V.118. № 1. P. 15.
- Rudolph M.I., Rojas I.G., Penissi A.B. //Biocell. 2004. V.28. №1. P. 1.
- Zhao X., Ma W., Das S.K. et al. //Development. 2000. Vol. 127. № 12. P. 2643.



