Альгологические исследования на Командорских островах имеют уже давнюю историю. К настоящему времени морские водоросли шельфа островов изучены довольно тщательно, имеется значительная литература, включающая и наши публикации по результатам более чем 25-летних исследований на Командорах, в ходе которых было обнаружено около 190 видов водорослей-макрофитов [8]. Но все же многое остается неизученным. В частности, из-за труднодоступности островов и сложных климатических условий, исследований в зимний период там не проводилось со времен Е.Ф. Гурьяновой [1] и Е.А. Кардаковой-Преженцовой [2]. Однако в 2011 году нам был передан интересный альгологический материал из зимних сборов сотрудника Командорского биосферного заповедника Н.Н. Павлова, за что мы выражаем ему глубокую благодарность. Эти сборы позволили получить новые данные по устойчивости к экстремальным природным факторам и репродуктивной стратегии ряда морских водорослей Командорских островов.
Цель данного исследования – показать особенности адаптивной стратегии командорских водорослей при максимальном использовании ими репродуктивного потенциала.
Материалы и методы исследования
Морские водоросли были собраны на самом крупном из островов Командорского архипелага – острове Беринга на литорали вблизи устья рек, где отсутствовал ледово-снежный покров, и из штормовых выбросов в феврале – начале марта 2011 года (рисунок).
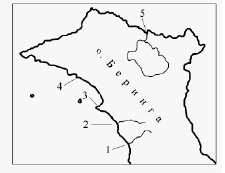
Карта-схема мест сбора водорослей на о. Беринга: 1 – устье реки Федоскина; 2 – устье реки Песчанка; 3 – пирс в селе Никольское; 4 – мыс Гаупта; 5 – устье реки Саранная
Отметим, что с фенологических позиций март считается на Командорах зимним месяцем, но самым холодным является февраль со средней температурой воздуха – 4°C.
В ходе сбора данной коллекции водорослей измерялась лишь поверхностная температура воды, и ее колебания оказались в интервале от – 0.1 до + 1.9 °C. Однако большинство образцов сублиторальных видов было собрано из выбросов, поэтому судить о глубине и температурных условиях их произрастания сложно. Но мы полагаем, что температура, при которой они развиваются, не сильно отличается от температуры водной поверхности. Согласно наблюдениям Е.А. Кардаковой-Преженцовой [2] на Медном, втором по величине острове Командорского архипелага, температура морской воды на глубинах от 0 до 25 м в феврале 1922–1931 гг. варьировала от 0 до + 0.2 °C, а в марте 1926–1931 г.г. на глубинах от 0 до 5 м – от + 1.4 до + 0.9 °C соответственно. Таким образом, температурные колебания в толще воды невелики и находятся в пределах вышеуказанных значений поверхностной температуры.
Определение видовой принадлежности водорослей проводилось при изучении образцов в световом биологическом микроскопе «Оlympus» CX-31 с приготовлением гистологических срезов вручную с помощью бритвенного лезвия. Срезы помещались в каплю пресной воды и изучались неокрашенными. Образцы изученных водорослей хранятся в КФ ТИГ ДВО РАН (Петропавловск-Камчатский).
Результаты исследования и их обсуждение
В результате обработки более 150 образцов нами обнаружено 57 видов водорослей-макрофитов (11 Chlorophyta, 13 Ochrophyta, class Phaeophyceae и 33 Rhodophyta) (таблица), из которых 47 видов (10 Chlorophyta, 7 Ochrophyta, class Phaeophyceae и 30 Rhodophyta) добавлены нами в имевшийся ранее список морских водорослей, указанных на Командорских островах в зимний период [2].
Наши флористические находки, среди которых 13 видов оказались новыми для флоры Командорских островов, а 6 явились также новыми для дальневосточных морей России, подробно рассмотрены в нашей предыдущей публикации [9]. В настоящей работе основное внимание уделено обсуждению особенностей репродуктивной стратегии ряда водорослей командорской популяции.
Все встреченные зеленые водоросли оказались стерильными, тогда как значительная часть видов бурых и красных водорослей находилась в фертильном состоянии. Образцы Saccharina bongardiana (Postels et Ruprecht) Selivanova, Zhigadlova et G.I. Hansen со спороносными пятнами на верхних (старых) частях пластин обнаружены с 10 февраля по 7 марта при поверхностной температуре воды от –0.1 до +1.9°С; S. dentigera (Kjellman) C.E. Lane, C. Mayes, Druehl et G.W. Saunders – с 10 по 19 февраля при температуре от –0.1 до +1°С. Эти факты подтверждают данные Ю.Е. Петрова [3, 5], отмечавшего, что спорангии у S. bongardiana наблюдались с июня до разрушения пластин, иногда до начала следующего года, а у S. dentigera – с октября (августа) по апрель, т.е. в обоих случаях спороношение захватывало зимний период.
Список морских водорослей из зимних сборов на острове Беринга
|
№ |
Вид |
Место сбора |
Cост. ферт. |
|
Отдел Chlorophyta |
|||
|
1 |
«Chlorochytrium inclusum» Kjellman |
5 |
- |
|
2 |
Chaetomorpha cannabina (Areschoug) Kjellman |
5 |
- |
|
3 |
Codium ritteri Setchell et N.L.Gardner |
2 |
- |
|
4 |
Epicladia flustrae Reinke |
3 |
- |
|
5 |
Rosenvingiella polyrhiza (Rosenvinge) P.C. Silva |
1, 5 |
- |
|
6 |
Ulva lactuca Linnaeus |
1, 4 |
- |
|
7 |
Ulvella geniculata (N.L. Gardner) R.Nielsen, C.J.O’Kelly et B.Wysor |
1–3 |
- |
|
8 |
Ulvella prostrata N.L.Gardner |
2 |
- |
|
9 |
Ulvella pterosiphoniae (Nagai) Selivanova et Zhigadlova |
2 |
- |
|
10 |
Ulvella ramosa (N.L.Gardner) R.Nielsen, C.J.O’Kelly et B.Wysor |
5 |
- |
|
11 |
Ulvella repens (Pringsheim) R.Nielsen, C.J.O’Kelly et B.Wysor |
2 |
- |
|
Отдел Ochrophyta, класс Phaeophyceae |
|||
|
12 |
Agarum clathrus (S.G. Gmelin) Greville |
3, 5 |
- |
|
13 |
Agarum turneri Postels et Ruprecht |
2 |
- |
|
14 |
Alaria angusta Kjellman |
1, 2, 5 |
+ |
|
15 |
Desmarestia intrmedia Postels et Ruprecht |
3 |
- |
|
16 |
Eualaria fistulosa (Postels et Ruprecht) M.J. Wynne (ювенильный образец) |
5 |
- |
|
17 |
Fucus evanescens C. Agardh |
2, 4, 5 |
+ |
|
18 |
Laminaria longipes Bory de Saint-Vincent |
3, 4 |
- |
|
19 |
Myrionema balticum (Reinke) Foslie |
1, 2 |
+ |
|
20 |
Myrionema magnusii (Sauvageau) Loiseaux |
5 |
+ |
|
21 |
Saccharina bongardiana (Postels et Ruprecht) Selivanova, Zhigadlova et G.I.Hansen |
1, 2, 5 |
+ |
|
22 |
Saccharina dentigera (Kjellman) C.E. Lane, C. Mayes, Druehl et G.W. Saunders |
2, 3, 5 |
+ |
|
23 |
Streblonema evagatum Setchell et N.L.Gardner |
2, 5 |
+ |
|
24 |
Streblonema myrionematoides Setchell et N.L.Gardner |
3 |
+ |
|
Отдел Rhodophyta |
|||
|
25 |
Acrochaetium arcuatum (K.M. Drew) C.K. Tseng |
1, 2 |
+ |
|
26 |
Acrochaetium densum (K.M. Drew) Papenfuss |
3 |
- |
|
27 |
Colaconema desmarestiae (Kylin) P.W. Gabrielson |
3 |
+ |
|
28 |
Colaconema endophyticum (Batters) J.T. Harper et G.W. Saunders |
5 |
+ |
|
29 |
Constantinea rosa-marina (S.G. Gmelin) Postels et Ruprecht |
2 |
- |
|
30 |
Erythrocladia irregularis Rosenvinge |
3 |
- |
|
31 |
Euthora cristata (C. Agardh) J. Agardh |
3 |
- |
|
32 |
Fimbrifolium spinulosum (Ruprecht) Perestenko |
5 |
- |
|
33 |
Halosaccion glandiforme (S.G. Gmelin) Ruprecht |
1 |
- |
|
34 |
Hymenena ruthenica (Postels et Ruprecht) A.D. Zinova |
2, 3, 5 |
- |
|
35 |
Meiodiscus concrescens (K.M. Drew) P.W. Gabrielson |
2, 3, 5 |
+ |
|
36 |
Membranoptera dimorpha N.L. Gardner |
1, 5 |
+ |
|
37 |
Membranoptera sp. (ювенильный образец) |
5 |
- |
|
38 |
Membranoptera spinulosa (Ruprecht) Kuntze |
1, 2 |
+ |
|
39 |
Mikamiella ruprechtiana (A.D. Zinova) M.J. Wynne |
5 |
- |
|
40 |
Neodilsea yendoana Tokida |
5 |
- |
|
41 |
Neopolyporolithon reclinatum (Foslie) W.H. Adey et H.W. Johansen |
5 |
- |
|
42 |
Neoptilota asplenioides (Esper) Kylin |
1–5 |
+ |
|
43 |
Neorhodomela aculeata (Perestenko) Masuda |
2, 4 |
- |
|
44 |
Neorhodomela larix (Turner) Masuda |
1 |
- |
|
45 |
Odonthalia setacea (Ruprecht) Perestenko |
3 |
+ |
|
46 |
Opuntiella ornata (Postels et Ruprecht) A.D. Zinova |
2 |
+ |
|
47 |
Palmaria stenogona Perestenko |
2 |
- |
|
48 |
Phycodrys riggii N.L. Gardner |
1–3, 5 |
+ |
|
49 |
Pleonosporium vancouverianum (J. Agardh) Setchell et N.L. Gardner |
3 |
- |
|
50 |
Pleuroblepharidella japonica (Okamura) M.J. Wynne |
2, 3, 5 |
+ |
|
51 |
Porphyra sp. (ювенильный образец) |
4 |
- |
|
52 |
Pterosiphonia bipinnata (Postels et Ruprecht) Falkenberg |
2 |
+ |
|
53 |
Ptilota filicina J. Agardh |
5 |
+ |
|
54 |
Ptilota serrata Kützing |
1, 2 |
+ |
|
55 |
Rhodophysema elegans (P.L. Crouan et H.M. Crouan ex J. Agardh) P.S. Dixon |
4 |
+ |
|
56 |
Tokidadendron bullatum (N.L. Gardner) M.J. Wynne |
4, 5 |
+ |
|
57 |
Turnerella mertensiana (Postels et Ruprecht) F. Schmitz |
3, 4, 5 |
+ |
Примечание. Принятые в таблице сокращения и условные обозначения: «Сост. ферт.» – состояние фертильности; « + » образцы с органами размножения, « – » образцы в стерильном состоянии. Места сбора водорослей указаны цифрами в соответствии с рисунком.
Фертильными оказались также образцы Alaria angusta Kjellman, обнаруженные с 10 февраля по 7 марта при поверхностной температуре воды от –0.1 до +1.9°С, при этом растения имели зрелые спорофиллы. по данным Ю.Е. Петрова [4], закладка молодых спорофиллов у этого вида происходит ранней весной. В более поздней работе этого автора [5] говорится о том, что созревание спорангиев приурочено к летне-осеннему периоду, но не исключено, что оно происходит и в другие сезоны года. В нашем случае трудно судить, является ли наблюдаемый нами процесс зимнего спороношения алярии началом нового весеннего сезона размножения или, что выглядит более вероятным с учетом степени зрелости спороносной ткани, продолжением предыдущего осеннего периода. Образцы остальных представителей порядка Laminariales были стерильными (Laminaria longipes Bory de Saint-Vincent, Agarum clathrus (S.G. Gmelin) Greville, Agarum turneri Postels et Ruprecht, Eualaria fistulosa (Postels et Ruprecht) M.J. Wynne).
Среди других бурых водорослей фертильными оказались образцы Fucus evanescens C. Agardh, обнаруженные с 10 по 21 февраля при температуре воды от – 0.1° до +1.0°С. Изученные образцы имели концептакулы, несущие оогонии. Эти данные дополняют наши выводы о растянутости фертильного периода у F. evanescens из прикамчатской акватории c весны до поздней осени [6, 7], но зимнего мониторинга нами ранее не проводилось. Как и в случае с алярией, в отношении фертильных зимних образцов фукуса из командорской популяции пока не ясно, представляют ли они начало нового весеннего сезона размножения или конец осеннего, или процесс размножения у этого вида перманентен. по данным Ю.Е. Петрова [5] у F. evanescens из Командорской популяции зрелые гаметангии обнаруживались лишь в летний период (в июне-июле), а на Камчатке закладка новых концептакулов отмечалась в октябре. Это согласуется с нашими прежними наблюдениями [7]. Зимние фертильные образцы F. evanescens оказались в нашем распоряжении впервые, поэтому мы пока воздержимся от однозначных выводов о круглогодичном размножении этого вида. Заметим только, что у другого вида фукуса – Fucus distichus Linnaeus, практически круглогодичный период размножения известен уже давно. Согласно той же работе Ю.Е. Петрова [5] закладка концептакулов у образцов F. distichus из акватории северных морей (Баренцева, Белого, Карского) наблюдалась с августа по февраль, гаметангии появлялись в октябре-ноябре, созревание гамет происходило в мае, а выход гамет завершался в июле-августе. Так что предположение об аналогичном перманентном периоде фертильности у тихоокеанского F. evanescens не выглядит неожиданным.
В литературе имеются данные о развитии близкородственного тихоокеанского вида из рода Fucus на американском побережье (южная часть Аляски, Орегон), а именно, одной из карликовых форм (экады) Fucus gardneri P.C. Silva, указываемой чаще всего как Fucus cottonii M.J.Wynne et Magne, свидетельствующие о том, что в некоторых популяциях эта водоросль способна размножаться зимой как половым путем, так и вегетативным – фрагментацией. У фертильных растений образуются эллипсолидной формы рецептакулы на верхушках основных ветвей, в которых развиваются двуполые концептакулы с 8 оогониями, что типично для рода в целом. После завершения цикла размножения рецептакулы отпадают от растений и обычно не обнаруживаются до поздней весны [10].
Из красных водорослей в репродуктивном состоянии обнаружены образцы следующих видов: Turnerella mertensiana (Postels et Ruprecht) F. Schmitz с гонимобластами при температуре +1.0°С; Opuntiella ornatа (Postels et Ruprecht) A.D. Zinova с гонимобластами при –0.1°С; Neoptilota asplenioides (Esper) Kylin с тетраспорангиями в интервале от –0.1° до +1.9°С; Ptilota filicina J. Agardh со сперматангиями при +1.9°C; Ptilota serrata Kützing с тетраспорами и гонимобластами при –0.1°С; Odonthalia setacea (Ruprecht) Perestenko с цистокарпами при + 1.0°С; Pterosiphonia bipinnata (Postels et Ruprecht) Falkenberg со сперматангиями при – 0.1°С; Pleuroblepharidella japonica (Okamura) M.J. Wynne с тетраспорами в интервале от + 1.0° до +1.9°C; Membranoptera dimorpha N.L. Gardner с цистокарпами при +1.9°С; Phycodrys riggii N.L. Gardner с тетраспорангиями при –0.1°С и с цистокарпами при + 1.9°С; Tokidadendron bullatum (N.L. Gardner) M.J. Wynne с цистокарпами при +1.9°C.
Итак, по нашим подсчетам почти половина обнаруженных зимой видов красных водорослей находилась в различных стадиях размножения, преимущественно полового. Многие из изученных водорослей размножаются и в другие сезоны года, так например, образцы водорослей семейства Furcellariaceae Opuntiella ornatа и Turnerella mertensiana из наших прежних многолетних сборов на Командорских островах имели женские генеративные структуры с июня по октябрь; образцы церамиевых водорослей семейства Wrangeliaceae Neoptilota asplenioides имели тетраспоры и гонимобласты в августе-сентябре, Ptilota filicina встречалась с тетраспорами и гонимобластами в июне-июле, Ptilota serrata – также с тетраспорами и гонимобластами в мае-сентябре; образцы Odonthalia setacea встречались с тетраспорами и цистокарпами с мая по сентябрь, а Pterosiphonia bipinnata с тетраспорами и цистокарпами – с мая по октябрь.
Как следует из вышеизложенного, с весны до осени среди командорских красных водорослей порядка Ceramiales отмечается одновременное развитие женских генеративных структур и тетраспорангиев, иначе говоря, наблюдается параллельное существование и развитие нескольких поколений этих багрянок, бесполых и половых. Однако среди весенне-летне-осенних образцов за долгие годы наблюдений на Командорских островах нам не попались мужские экземпляры (со сперматангиями), которые были обнаружены у зимних образцов Ptilota filicina и Pterosiphonia bipinnata. Связано ли это с особенностями сезонного развития церамиевых водорослей из командорской популяции, пока нельзя сказать однозначно. Тем не менее, у ряда камчатских представителей тех же таксономических групп отмечено одновременное развитие в июле-августе всех органов размножения, как мужских и женских генеративных структур, так и тетраспорангиев [7].
Из других размножающихся в зимнее время багрянок боннемезониевая водоросль Pleuroblepharidella japonica обнаружена только с тетраспорами, также как и летние экземпляры этого вида, встреченные в июле-августе. У делессериевых водорослей распределение стадий размножения между зимними и летними образцами иное: Membranoptera dimorpha, обнаруженная в марте с цистокарпами, в прежних сборах в августе и ноябре была стерильной; мартовские образцы Tokidadendron bullatum, также несущие цистокарпы, с июня по август имели только тетраспоры; и наконец, Phycodrys riggii прежде встречался в июне-сентябре с тетраспорами, но в зимних сборах наряду с тетраспоровыми, обнаружены также образцы с цистокарпами, которые ранее нам не попадались ни в командорском, ни в камчатском материале.
Заключение
Исходя из полученных данных, зима на Командорских островах не является периодом покоя для морских растений. Сроки жизни и активного размножения бентосных водорослей на острове Беринга очень растянуты и не приурочены к определенным сезонам года. Как правило, осенью происходит массовая элиминация водорослей в силу биологических причин и в связи с изменением гидрологических условий – наступлением периода частых и мощных осенних штормов, и как следствие, усилением интенсивного механического воздействия на заросли водорослей. Тем не менее, командорские водоросли, которые успевают к осени вырасти, успешно отспороносить и дать потомство, вовсе не элиминируются полностью. Водоросли из осенней генерации продолжают расти и формировать органы спороношения также и в зимний период. Сильных зимних морозов на Командорах практически не бывает, поэтому литоральные водоросли не подвержены столь же губительному воздействию низких температур, которое производят осенние штормы. А для многих сублиторальных водорослей, судя по их активному размножению, условия зимнего существования вообще близки к оптимальным. Вероятно, относительная стабильность температуры водной толщи, практическое отсутствие ледового покрова, дающее возможность проникновения на глубину солнечного света и создающее благоприятные условия для нормального фотосинтеза, способствуют росту и развитию морских водорослей в зимнее время, не менее успешному, чем в другие сезоны года.



