Обработка воды с целью снижения содержания в ней солей и токсичных примесей широко применяется в различных отраслях промышленности. В машиностроительных отраслях она используется для очистки сточных вод. На химических производствах – для обработки технологических растворов и очистки сточных вод. В энергетике – для получения обессоленной воды для выработки электроэнергии и тепла.
Независимо от производственного назначения процесса химические реакции имеют общий характер и основаны на выделении из растворов малорастворимых соединений солей и гидроксидов.
Для получения твердых осадков исходные водные системы обрабатывают щелочными реагентами. Наиболее распространёнными способами являются содово-каустический и содово-известковый методы [3, 4, 10]. Природные и промышленные воды содержат в своём составе катионы кальция и магния. При добавлении щелочных реагентов в воду и повышении значения рН образуются малорастворимые соединения карбоната кальция и гидроксида магния, которые выделяются в твердую фазу [9, 10]. В зависимости от целевого назначения процессов предъявляют различные требования к физико-механическим свойствам осадка. В значительной степени эти характеристики определяются структурой и дисперсностью получаемой твердой фазы [2–4, 7].
Прогресс в технологии седиментации с последующим отстаиванием и фильтрацией может быть достигнут за счёт глубокого изучения особенностей этих процессов и применения полученных рекомендаций на практике [1–2, 5–8].
Образование грубодисперсных взвесей карбоната кальция и гидроксида магния является сложным физико-химическим процессом. Можно выделить следующие основные стадии его осуществления:
– обменные химические реакции между катионами кальция и магния и добавленными реагентами с образованием новых веществ;
– образование зародышей твердой фазы из молекул карбоната кальция и гидроксида магния;
– процессы коагуляции, в результате которых происходит укрупнение частиц твердой фазы;
– перекристаллизация гетерогенных частиц и образование кристаллов.
Скорость достижения химического равновесия будет определяться скоростью перехода образовавшихся молекул новых веществ в твердую фазу, а полнота реакций – растворимостью образованных гетерогенных соединений.
Мы изучали этот процесс на примере обработки воды природных водных источников.
Взвешенные частицы в природных водах могут различаться по размерам в очень широких пределах. Возможные диаметры частиц составляют от 5∙10–9 до 10–4 м. Если частицы достаточно велики (d > 30–50 мкм), то они могут выделяться отстаиванием или удаляться с помощью фильтрации.
Процесс выделения частиц в осадок в значительной степени определяется кинетикой переноса реагирующих веществ и их агрегацией. Для частиц размером менее 10 мкм конечная скорость осаждения меньше 10–2 см/с. Это означает , что только одно из 104–106 столкновений приводит к удовлетворительной агломерации. В природных условиях благодаря длительному времени существования обеспечивается достаточная вероятность контакта частиц, несмотря на очень малую частоту столкновения.
Если контакт между частицами происходит в основном за счёт броуновского движения, то скорость их выделения в осадок будет определяться соотношением
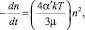 (1)
(1)
где n – концентрация частиц (число частиц в 1 см3); t – время; α′ – фактор интенсивности столкновения, который отражает химические свойства частиц; G – средний градиент скорости (время–1), характеризующий скорость, с которой происходит контакт между частицами при массопереносе; Ф – объём взвешенных частиц, приходящихся на единицу объёма раствора; k – константа Больцмана; Т – абсолютная температура; µ – вязкость жидкости.
В промышленных условиях показатели α′ и G малы, что приводит к продолжительному времени образования и отстаивания твердой фазы В производственных процессах для ускорения реакций обмена и осаждения приходится применять дополнительные меры. Для сокращения времени осаждения частиц малого диаметра процесс агломерации совмещают с коагуляцией и в раствор вводят дополнительно коагулянты и флокулянты.
Для процесса коагуляции было предложено кинетическое уравнение, которое определяет скорость образования твердых частиц:
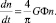 (2)
(2)
Повышение скорости образования осадков достигается за счет увеличения показателей G и Ф.
Соли железа и алюминия, которые используют в промышленности в качестве коагулянтов, относятся к агрегатирующим агентам. Они обладают способностью образовывать полиядерные продукты гидролиза 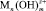 , которые хорошо адсорбируются на поверхности раздела частица – вода. На этих комплексах могут адсорбироваться катионы, например Mg2+, Ca2+, катионы тяжёлых металлов, Н+, а также анионы, как например
, которые хорошо адсорбируются на поверхности раздела частица – вода. На этих комплексах могут адсорбироваться катионы, например Mg2+, Ca2+, катионы тяжёлых металлов, Н+, а также анионы, как например 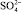 , Cl–,
, Cl–, 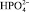 и ОН–, которые присутствуют в воде.
и ОН–, которые присутствуют в воде.
Специфическую адсорбцию катионов и анионов на поверхности гидроксидов объясняют реакциями комплексообразования. Эти соединения являются амфотерными. Ионы Н+ и ОН-– являются для гидроксидов потенциалопределяющими ионами. Заряд частиц золей гидроксидов будет зависеть от рН среды. Группы ОН на поверхности гидроксидов имеют комплексообразующие О-донорные группы. Ион водорода и ионы металлов, присутствующие в растворе, конкурируют друг с другом в возможных для координации точках на поверхности:
МОН + Мz+ = МОМ(z–1) + Н+; (3)
2МОН + Мz+ = (МО)2М(z–2) + 2Н+. (4)
Аналогичная замена лигандов комплексообразующими анионами приводит к удалению иона ОН– с поверхности:
МОН + Аz– = М – А(z–1) + ОН–; (5)
2МОН + Аz– = (МО)2А(z–2) + 2ОН–. (6)
На поверхности коллоидных частиц присутствует избыточный электрический заряд. Двойной электрический слой, возникающий на границе твёрдая фаза – раствор, препятствует слипанию и укрупнению коллоидов. Заряд частиц зависит от состава водной фазы. Нарушение устойчивости коллоидных систем при коагуляции или флокуляции достигается за счёт введения веществ, которые способствуют слипанию или соединению частиц. Макромолекулы природных и искусственных веществ, в частности полиэлектролитов, имеют высокую тенденцию к накоплению на поверхности раздела фаз.
Специфически адсорбированные ионы могут изменять величину поверхностного заряда, и степень их адсорбции будет определяться величиной рН раствора. Адсорбция анионов снижает заряд частиц, в то время как адсорбция катионов вызывает его повышение.
Коэффициент эффективности единичной связи зависит от размера и плотности удаляемых частиц. Для переноса частиц требуется или движение частиц относительно друг друга или перемещение их к поверхности выпавшей в осадок частицы. Вероятность столкновения частиц зависит от произведения Gt.
Химические факторы определяют особенности взаимодействия коллоидов. Изменяя химические взаимодействия, можно увеличить эффективность столкновения частиц друг с другом и с зёрнами фильтра и сделать процессы коагуляции и фильтрации более эффективными.
Приведенные выше сведения позволяют выбрать наиболее пригодные для практических целей методы удаления взвешенных веществ. Применимость метода зависит от концентрации взвешенных частиц и их размеров. Коагуляция с последующим отстаиванием может завершиться быстро, если концентрация частиц достаточно велика для обеспечения вероятности их контакта.
Технология проведения операции коагулирования определяется спецификой промышленного процесса.
В настоящей статье представлены данные о структуре и дисперсности осадков, образующихся при обработке природной воды щелочными композитами. В качестве щелочных реагентов использовали щелочь, её растворы с различными добавками соды и коагулянтов, а также импортный препарат Гидро-Х, выпускаемый датской фирмой HIDRO-X. Полученные осадки отфильтровывали и обрабатывали по методике, изложенной в более ранних работах [4, 6, 9]. Структуру и дисперсность осадков изучали с использованием электронного микроскопа.
Как показали наши исследования, длительность и закономерности процесса осаждения и вид получаемых осадков определяются размером первоначально образующихся частиц.
Основными технологическими показателями, влияющими на процесс образования и осаждения твердой фазы, являются температура и величина рН.
На практике температура обработки воды в различных процессах изменяется в пределах 30–100 °С, значения рН варьируются от 8,0 до 12,5.
Проведенные ранее исследования с использованием воды природных источников показали, что в интервале РН = 8,5–10,3 выделяется только карбонат кальция, а образование нерастворимых соединений магния не происходит.
При рН более 11,5 образование карбоната кальция заканчивается и выделяется только гидроксид магния.
В узкой области рН = 10,3–11, 5 возможно совместное образование двух соединений.
Ниже приведены результаты по исследованию структуры образующихся осадков, полученных при 50 °С и при изменении показателя щелочности среды.
Выявленные закономерности показали возможность проводить целенаправленное обессоливание воды, воздействуя на характер образующегося осадка количеством добавляемого щелочного реагента и регулируя величину рН.
Образование и осаждение карбоната кальция при обработке воды.
Область рН = 8,5–10,3.
В исследуемой области рН происходит только реакция образования CaCO3. Растворы карбоната кальция склоны к пересыщению и выделение твердой фазы из пересыщенных растворов затруднено [2, 7–8].
В зависимости от концентрации катионов кальция в исходной воде и условий проведения процесса карбонат кальция может выделяться в виде аморфных образований или в виде кристаллических зародышей. Соотношения между различными типами процессов осаждения регулируются многими факторами.
В начальный период времени в условиях высокой концентрации катионов кальция (более 100 мг/л) образуется тиксотропная аморфная структура, обладающая рыхлостью и малой прочностью. В процессе осаждения хлопьев их структура подвергается сложным изменениям. Хлопья могут срастаться между собой и образовывать единую структуру, которая медленно уплотняется. Со временем она распадается и начинает протекать процесс кристаллизации.
При исходной концентрации ионов кальция в растворе до 100 мг/л карбонат кальция выделяется в виде отдельных свободно оседающих кристаллов, размеры которых увеличиваются во времени (рис. 1). Во всём интервале изменения параметров образуется карбонат кальция первоначально в виде арагонита, который затем переходит в кальцит. На дериватографической кривой разложения осадка наблюдают эндотермический пик при температурах 850–900 °С с потерей массы около 44 %, что свидетельствует о разложении кальцита. На рентгенограммах также отмечают пики, характерные для этого соединения.
Мы провели изучение структуры осадков, образующихся при обработке воды щелочными реагентами при значениях РН, равных 8,5–10,3. В этих условиях в осадок выпадает только карбонат кальция.
На рис. 1 приведены микрофотографии осадка, полученного после обработки природной воды щелочно-содовым реагентом без применения коагулянта. Температура воды составляла 50 °С, рН = 9,8. Верхний рисунок получен через 15 минут после добавления реагента, а нижний рисунок – через 2 часа. Как видно из снимков карбонат кальция выпадает первоначально в виде мелких кристаллов, размер которых со временем увеличивается.
При применении щелочи процесс формирования осадка завершался за 1,5 часа. Если использовать комплексный осадитель (реагент Гидро-Х), в состав которого входят коагулянты, то время осаждения твердой фазы сокращается до 0,5 часа, но при этом получают неплотные и подвижные осадки, содержащие более мелкие кристаллы. При повышении температуры до 100 °С осаждение соли происходит в течение нескольких минут. Размеры кристаллов составляют 5–10 мкм. Они чётко фиксируются на фотоснимках с микроскопа.
В промышленности обработку воды содово-каустическим методом применяют для получения теплоносителей, выработки электроэнергии, в производстве микросхем. В этих процессах более целесообразно применять комплексные щелочные композиты.
Образование и осаждение гидроксида магния. Область рН более 11,5.
Гидроксид магния первоначально выделяется в твердую фазу в виде элементарных частиц, беспорядочно сцепленных между собой в сетчатую структуру. Размер частиц составляет 0,03–0,04 мк. При применении коагулянтов частицы со временем укрупняются и достигают размера до 50 мк. Вторичные частицы пористы, содержат много влаги, образуют пластинчатую структуру. Они очень слабо связаны между собой в хлопья. Процесс хлопьеобразования замедлен.
Большое влияние на скорость процесса и структуру осадка оказывает содержание щелочи в растворе. С возрастанием концентрации щелочи увеличивается гидратация частиц гидроксида магния. Возрастает расклинивающее действие гидратной оболочки, окружающей частицы. В результате уменьшается прочность хлопьев, возрастает их рыхлость и обводненность. В состав осадка входит большое количество жидкой фазы. В силу этого плотность осадка незначительно отличается от плотности жидкой фазы и выделение твердой фазы в осадок не происходит.
При обработке воды частицы образующегося гидроксида магния составляют размер порядка нескольких сотых долей микрона. Их не удаётся рассмотреть при использовании обычного микроскопа. Если проводят процесс при повышенных температурах, то наблюдается быстрое спонтанное образование большого количества мелких частиц. Они равномерно распределены в растворе и не наблюдается чёткой границы между осадком и раствором. Частицы не оседают на дно, а со временем обволакивают стенки сосуда.
На рис. 2 приведена микрофотография осадка, полученного при обработке воды раствором щелочи. Температура проведения опытов 50 °С, рН = 9,8. На микрофотографии не выявлено образование упорядоченной структуры твердой фазы
В промышленности такой вид осадков получают при очистке высокомагнезиальных вод, в энергетическом комплексе – при обработке продувочных вод котлов с высоким остаточным содержанием магния, в химической промышленности – при получении соды. Осадки трудно утилизировать и переработать. Для их хранения приходится строить большие отстойники.
Консолидированное образование и соосаждение карбоната кальция и гидроксида магния. Область рН = 10,3–11,5.
Различают два вида осаждения частиц при очистке воды – свободное и совместное. При свободном осаждении каждая частица оседает со скоростью, зависящей от её размера и плотности. Такой режим осаждения для карбоната кальция CaCO3 мы наблюдали при рН = 8,5–10,3 и для гидроксида магния Mg(OH)2 при рН более 11,5.
При исследовании осадков, полученных в процессе водоподготовки природной воды в условиях консолидированного соосаждения карбона кальция и гидроксида магния, мы не обнаружили частиц, имеющих кристаллическую структуру. Данные структурного анализа свидетельствовали об образовании аморфных частиц, размеры которых составляли сотые доли микрона. Таким образом, при обработке воды при рН = 10,3–11,5 первоначально образуются соединения магния, имеющего размеры наночастиц, которые и определяют закономерности технологического режима водоподготовки. При исследовании состава осадков удалось выяснить, что образуются преимущественно сложные карбонатно-гидроксидные соединения кальция и магния типа Mg(OH)2.4MgCO3.4H2O.
Они имеют на дериватографической кривой несколько эндотермических пиков, ответственных за процессы дегидратации и разложения.
Осадки получаются достаточно компактные и легко отфильтровываются. Этот режим благоприятен в технологических условиях и может быть легко реализован.

Рис. 2. Микрофотографии (увеличение в 400 раз) осадков гидроксида магния



Рис. 3. Микрофотографии осадков карбоната кальция и гидроксида магния через 2 часа после добавления щелочи. Увеличение: верхний снимок – ×200, средний снимок – ×500, нижний снимок – ×1250


Рис. 1. Микрофотографии (увеличение в 400 раз) осадков карбоната кальция через 15 минут (верхний снимок) и через 2 часа (нижний снимок) после добавления в воду щелочного реагента
Библиографическая ссылка
Семенова И.В. ИЗУЧЕНИЕ СТРУКТУРЫ И ДИСПЕРСНОСТИ КАЛЬЦИЙ-МАГНИЕВЫХ ОСАДКОВ МЕТОДОМ ЭЛЕКТРОННОЙ МИКРОСКОПИИ // Успехи современного естествознания. – 2015. – № 9-2. – С. 339-344;URL: https://natural-sciences.ru/ru/article/view?id=35588 (дата обращения: 18.04.2024).



