Возможность бесконтактной активации жидкостей была предсказана И.Л. Герловиным, на основе теории фундаментального поля [2]. Анализируя механизм контактной электрохимической активации, он пришел к выводу, что существует возможность бестоковой активации, когда электроды изолированы от активируемой жидкости слоем диэлектрика. Первые экспериментальные исследования по бесконтактной активации растворов в мембранном электролизере были выполнены В.М. Бахиром [1, 6] и В.Г. Широносовым [7] в электролизере без диафрагмы. Феномен бесконтактной электрохимической активации В.Г. Широносов объясняет возникновением вблизи анода и катода устойчивых высокоэнергетических резонансных систем из осциллирующих диполей [7].
Число публикаций по бесконтактной активации невелико. Одной из причин этого является, вероятно, малое время жизни бесконтактно активированных жидкостей. Если для электрохимически активированных растворов это время составляет от 1 суток до нескольких дней или даже месяцев, в зависимости от химического состава, то для бесконтактно активированных жидкостей спустя 2 часа наблюдается четкая тенденция к релаксации [6].
Целью работы было изучение свойств бесконтактно активированной воды и разбавленных водных растворов неорганических соединений.
Материалы и методы исследования
В качестве бездиафрагменного электролизера был использован активатор электрический модель «Здрава – 3.3» (изготовитель ОАО «Дальприбор», разработчик ЗАО НИЦ «Икар», Ижевск). Активатор представляет собой емкость в виде полого цилиндра вместимостью 3000 мл. Катодом служит внутренняя поверхность корпуса активатора, анод выполнен в виде стержня и расположен вертикально в центре емкости для активации. Бесконтактную активацию проводили в пищевых одноразовых стаканах из полипропилена, вместимостью 100 мл с толщиной стенки не более 0,3 мм. Стакан помещали в специальный держатель (входит в комплект активатора). Держатель вместе со стаканом погружали в водопроводную воду, очищенную бытовым фильтром «Гейзер». Объем воды в активаторе составлял 3000 мл, объем активируемого раствора в стакане – 50 мл. Бесконтактной электрохимической активации были подвергнуты дистиллированная вода, вода из природных источников, водопроводная вода, очищенная бытовым фильтром «Гейзер», а также растворы сильных окислителей – перманганата калия и бихромата калия, раствор серной кислоты, восстановителя сульфита натрия и растворы, содержащие смесь ионов железа разной степени окисления – раствор железоаммиачных квасцов и соли Мора, и раствор ферри- и ферроцианида калия.
Для получения удовлетворительной воспроизводимости результатов была подобрана следующая схема эксперимента. Объем воды, используемый в качестве среды для бесконтактной активации предварительно контактно активировали не менее 6 часов. Использование одной и той же воды в течение нескольких дней позволяло получать относительно стабильные результаты
рН и ОВП измеряли с помощью рН-метров иономеров «Экотест-2000» и «Экотест-120» (НПП «Эконикс», Москва). Для измерения рН использовали ионселективный стеклянный электрод с твердым контактом «ЭКОМ-рН» (НПП «Эконикс», Москва).
Окислительно-восстановительный потенциал измеряли при помощи высокотемпературных электродов платиновый электрод ЭПВ-1ср., (РУП «Гомельский завод измерительных приборов», Беларусь). В качестве электрода сравнения использовали хлорсеребряный электрод ЭВЛ-1М3.1 (РУП «Гомельский завод измерительных приборов», Беларусь).
Для калибровки приборов использовали стандартные буферные растворы фирмы HANNA со стандартными значениями рН 4,01; 7,01; 10,01 и стандартные растворы для оксредметрии со значением ОВП 240 и 480 мВ. Воспроизводимость значений ОВП была не хуже ±15 мВ, рН – ±0,02 ед.
Спектры поглощения растворов измеряли на спектрофлуориметре СМ 2203 (ЗАО «Солар», Беларусь).
Реактивы бихромат калия (х.ч), железоаммиачные квасцы (ч.д.а.), соль Мора (ч.д.а.), желтая кровяная соль (х.ч.), красная кровяная соль (х.ч.), хлорид калия (х.ч.) использовали без предварительной очистки. Растворы готовили на дистиллированной воде.
Результаты исследования и их обсуждение
Исследования электрохимически активированных растворов выявило, что окислительно-восстановительный потенциал испытывает в результате активации значительные изменения [1, 6, 7]. Вода из катодного пространства (католит) имеет отрицательные значения окислительно-восстановительного потенциала. Именно этот показатель был подвергнут В.М. Бахиром с соавторами тщательному анализу. Был сделан вывод, что отрицательный ОВП активированных жидкостей свидетельствует об антиоксидантной активности этих растворов и способствует защите организма от неблагоприятных факторов окружающей среды [6, 8]. Между низкими значениями окислительно-восстановительного потенциала и электронодонорными свойствами растворов был поставлен знак равенства. В дальнейшем представления об электронодонорных свойствах католита стали общепризнанными. Гипотеза о том, что низкие значения ОВП электрохимически активированной воды определяют ее высокую антиоксидантную активность стимулирует создание растворов с отрицательными ОВП в качестве антиоксидантов.
В таблице представлены результаты измерений, отражающие особенности бесконтактной электрохимической активации изученных соединений. Предельные значения ОВП дистиллированной, бутилированной и природной воды при активации составляло примерно –200... –230 мВ и не зависело от общей минерализации воды. Релаксация воды протекала в колебательном режиме. Характер колебаний подобен наблюдаемому для контактно активированных в бездиафрагменном электролизере различных типов вод [3]. Удивительным оказалось то, что активированный раствор сильного окислителя бихромата калия приобретает отрицательное значение окислительно-восстановительного потенциала, т.е., следуя логике авторов, связывающих отрицательный окислительно-восстановительный потенциал электрохимически активированного раствора с его антиоксидантными свойствами, формально такой раствор должен быть сильным восстановителем. Для разрешения парадокса отрицательного ОВП окислителя была проведена реакция между активированным бихроматом калия и сульфитом натрия в сернокислой среде. В качестве контроля была использована реакция исходного бихромата калия с тем же сульфитом натрия. Оказалось, что взаимодействие активированного раствора бихромата калия с сульфитом натрия протекает так же, как и в случае использования необработанного раствора. Данное обстоятельство свидетельствует о том, что резкое уменьшение окислительно-восстановительного потенциала активированных растворов отражает не изменение их окислительно-восстановительных свойств, а является следствием изменения кинетики электродных процессов [9].
При электрохимической активации наряду с активацией происходят также электрохимические превращения. Среди продуктов электрохимических реакций могут быть восстановители, ответственные за отрицательный ОВП воды. Существует мнение, что причиной отрицательных значений окислительно-восстановительного потенциала католита является молекулярный водород [4].
Изменение электрохимических параметров растворов при активации
|
Раствор |
С, моль/л |
Исходный |
Активированный |
∆ОВП, мВ |
||
|
рН |
ОВП, мВ |
рН |
ОВП, мВ |
|||
|
Дистиллированная вода |
55,56 |
5,056 |
386 |
5,125 |
–230 |
616 |
|
Бутилированная вода «Vittel» |
55,56 |
7,94 |
285 |
7,89 |
–273 |
558 |
|
Серная кислота |
0,1 |
1,236 |
558 |
1,112 |
87 |
471 |
|
Бихромат калия |
7,4∙10–2 |
4,127 |
465 |
4,130 |
–230 |
695 |
|
Бихромат калия |
7,4∙10–3 |
4,412 |
441 |
4,458 |
–260 |
701 |
|
Бихромат калия |
7,4∙10–4 |
4,978 |
386 |
5,012 |
–300 |
686 |
|
Бихромат калия в 0,001 М HClO4 |
2,0∙10–4 |
2,510 |
645 |
2,517 |
–257 |
902 |
|
Перманганат калия |
2,0∙10–3 |
5,517 |
788 |
5,599 |
725 |
63 |
|
Перманганат калия |
2,0∙10–4 |
5,421 |
765 |
6,306 |
705 |
60 |
|
Перманганат калия в 0,001 М NaOH |
2,0∙10–4 |
10,822 |
359 |
10,460 |
361 |
2 |
|
Сульфит натрия |
0,13 |
9,885 |
68 |
9,164 |
–701 |
769 |
|
Соль Мора + железоаммачные квасцы в 0,05М H2SO4 |
0,022 0,017 |
1,482 |
445 |
1,476 |
183 |
262 |
|
K4[Fe(CN)6] + K3[Fe(CN)6] в фосфатном буфере (рН = 6,86) |
0,005 0,005 |
6,89 |
245 |
6,80 |
250 |
-5 |
В условиях бесконтактной активации влияние водорода на потенциал индикаторного электрода можно не учитывать, тем не менее на платиновом электроде устанавливается отрицательный потенциал. Следовательно, кроме газообразного водорода существуют другие причины снижения окислительно-восстановительного потенциала воды.
Из таблицы видно, что активация растворов бихромата калия разной концентрации приводит к примерно одинаковому сдвигу ОВП, равному 685–700 мВ. В течение 30–40 минут активированный раствор бихромата калия сохраняет достигнутое при активации значение ОВП, а затем начинается процесс релаксации, который протекает в колебательном режиме и характеризуется резкими перепадами значений ОВП (рис. 1).
В отличие от бихромата калия, перманганат калия незначительно изменяет ОВП при активации. Сдвиг ОВП составляет примерно 60 мВ в дистиллированной воде. В 0,001 М растворе гидрата окиси натрия изменения ОВП перманганата калия не происходит. Эти результаты не согласуются с данными работы, в которой приведены значения ОВП для бесконтактно активированного 0,006 % KMnO4 – приблизительно – 600 мВ. Описания схемы активации и рН раствора в работе не приводится.
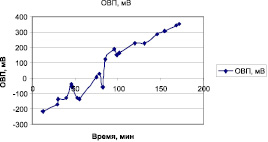
Рис. 1. Изменение окислительно-восстановительного потенциала бесконтактно активированного раствора бихромата калия во времени. Концентрация K2Cr2O7 равна 2,76∙10–4 М
Активация растворов, содержащих в равных концентрациях ферро- и феррицианид калия не приводит к изменениям окислительно-восстановительного потенциала растворов, в то время как сернокислый раствор, содержащий ионы двух- и трехвалентного железа уменьшает потенциал на 260 мВ.
При бесконтактной активации отсутствует физический контакт жидкости с материалом электродом, поэтому можно было бы предположить, что интенсивность химических превращений в этом случае по сравнению с контактной активацией будет мала. Если допустить, что причиной низкого окислительно-восстановительного потенциала являются восстановительные свойства раствора, обусловленные образованием и стабилизацией гидратированного электрона, то в ходе бесконтактной активации растворов сильных окислителей следует ожидать их восстановления. Известно [5], что такие сильные окислители, как перманганат-, хромат- и бихромат-ионы имеет скорости реакций с гидратированным электроном, превышающие константу скорости диффузии и активно восстановливаются гидратированным электроном. Из данных, представленных в таблице видно, что в отличие от бихромата калия ОВП, которого претерпевает большой сдвиг, в случае перманганата калия эти изменения в 10 раз меньше, а в случае слабо-щелочного раствора изменений окислительно-восстановительного потенциала не происходит.
С тем, чтобы выявить возможное восстановление раствора KMnO4 при активации были измерены спектры поглощения растворов до и после активации и исследована реакция восстановления раствора перманганата калия раствором сульфита натрия.
Для проведения бесконтактной электрохимической активации был приготовлен раствор перманганата калия в 0,001 М NaOH (250 мл) с концентрацией 2,0∙10–4 М. Активацию проводили в одноразовых стаканчиках, вместимостью 100 мл, закрытых пищевой фольгой. В каждый стаканчик помещали 50 мл раствора. На рис. 2 представлены спектры поглощения исходного раствора (1) и подвергнутого активации в течение 2,5 часов при включенном активаторе (2). Из рисунка видно отчетливое увеличение оптической плотности в коротковолновой области спектра, и незначительное уменьшение поглощения в полосе перманганат-иона. Следующую порцию раствора перманганата калия поместили в отключенный электрохимический активатор, содержащий активированную воду на 20 часов. Исходный малиновый раствор перманганата калия стал красным.
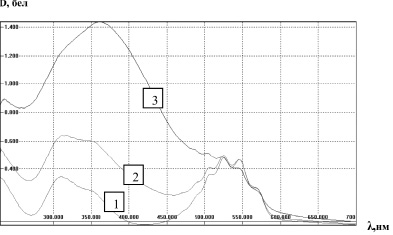
Рис. 2. Изменения спектра поглощения щелочного раствора (0,001М NaOH) перманганата калия (С = 0,0002М) при бесконтактной электрохимической активации: 1 – исходный раствор; 2 – активированный в течение 2,5 часов при включенном активаторе; 3 – активированный в течение 20 часов при выключенном активаторе
В случае длительной активации в отсутствие тока происходят разительные изменения спектра поглощения раствора перманганата калия. Уменьшение оптической плотности в области полосы поглощения не слишком велики, однако в области 300–400 нм наблюдается рост оптической плотности почти в 3 раза. Наблюдаемые изменения спектров поглощения не имеют аналогов при химическом восстановлении KMnO4. При добавлении к раствору перманганата калия таких восстановителей, как сульфит натрия, щавелевая кислота, перекись водорода происходит его восстановление до двуокиси марганца, раствор окрашивается в бурый цвет. При этом в спектрах поглощения можно наблюдается бесструктурное поглощение с широким максимумом около 300 нм монотонно спадающее в области 350–700 нм. Исследование природы полосы поглощения в бесконтактно активированном растворе перманганата калия требует дополнительных исследований.
Активацию раствора бихромата калия проводили так же, как и перманганата калия. При этом изменений спектра поглощения не наблюдалось.
Заключение
Бесконтактная химическая активация растворов приводит к значительным изменениям их свойств, которые выражаются либо в изменении ОВП растворов, которое носит обратимый характер, либо приводит к необратимым химическим превращениям. В этом случае резких изменений ОВП не происходит.
Активация бихромата калия приводит к резким изменениям ОВП, достигающим 700–900 мВ. Спектр поглощения активированного раствора не отличается от спектра исходного раствора. Релаксация активированного раствора начинается спустя 0,5–1 ч, в течение последующих 2 ч наблюдаются выраженные периодические колебания значений ОВП, в течение суток раствор релаксирует к значениям ОВП, близким к исходному.
Активация перманганата калия в слабощелочном растворе протекает без изменения ОВП. Спектр поглощения претерпевает резкие изменения и отражает образование неизвестного продукта превращения перманганата калия.
Отрицательные значения ОВП активированных растворов не характеризуют их окислительно-восстановительные свойства.
Библиографическая ссылка
Некрасова Л.П. НЕОБЫЧНЫЕ СВОЙСТВА НЕКОТОРЫХ БЕСКОНТАКТНО АКТИВИРОВАННЫХ РАСТВОРОВ // Успехи современного естествознания. – 2013. – № 4. – С. 87-91;URL: https://natural-sciences.ru/ru/article/view?id=31753 (дата обращения: 18.04.2024).



