Ключевыми полупродуктами в синтезе практически важных органических соединений: антибиотиков, хиральных катализаторов, реагентов для разделения оптических изомеров в результате их дериватизации и пр. являются хиральные амины, в структуре которых аминогруппа находится вблизи асимметрического центра. Стереоконфигурация и оптическая чистота указанных соединений играют решающую роль, как для избирательности протекания химических процессов, так и для проявления биологической активности [1]. Поэтому разработка рациональных подходов к синтезу энантиомеров хиральных аминов представляет значительный интерес. Несмотря на то, что в последнее время появилось множество катализаторов для асимметрического синтеза оптически чистых соединений [2, 3], в промышленных масштабах преобладают методы оптического разделения рацематов, в том числе методы кинетического разделения. Процессы кинетического разделения рацематов активно изучаются и считаются одними из наиболее современных и эффективных подходов к синтезу оптически чистых соединений [4, 5]. Кинетическое разделение рацемических соединений – это процесс достижения частичного или полного разделения, основанный на различиях в скоростях реакции отдельных энантиомеров с хиральным агентом (реагентом, катализатором, растворителем и др.) [6]. Суть метода заключается в том, что под действием хирального нерацемического агента один из энантиомеров рацемата реагирует быстрее, чем другой.
Ранее нами был разработан оригинальный метод синтеза ключевого полупродукта в синтезе высокоактивного антибактериального препарата левофлоксацин – (S)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина высокой оптической чистоты (ee > 99 %) в результате кинетического разделения рацемата при ацилировании хлорангидридом (S)-напроксена [7].
В последнее время огромный прогресс достигнут в области ферментативного кинетического разделения рацематов [8, 9]. Ферменты часто демонстрируют высокий уровень энантиоселективности, что позволяет использовать их в фармацевтической промышленности для синтеза лекарственных препаратов [10–12]. Преимущество ферментативного катализа над химическим синтезом заключается в том, что, как правило, использование фермента позволяет получить продукт с более высокой степенью оптической чистоты. Ферментативные реакции протекают при нормальной температуре и давлении, что позволяет избежать более экстремальных условий, которые в свою очередь могут привести к проблемам изомеризации и рацемизации. Использование живых микроорганизмов обладает рядом преимуществ перед ферментами, поскольку отсутствует необходимость выделять отдельный фермент и очищать его. Микробиологические процессы, как правило, осуществляются в водном растворе. Это позволяет избежать использования экологически вредных химических веществ, используемых в химических процессах. В связи с этим разработка биокаталитических технологий является перспективной для биотехнологии и фармакологии [1].
В частности, ранее сообщалось об эффективном микробиологическом синтезе (S)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина в результате гидролиза соответствующего N-ацетил производного в присутствии микроорганизмов рода Bacillius [13], Rhodococcus erythropolis 25 и Microbacterium paraoxydans 20-11с [14].
Цель исследования: исследование нового штамма Rh. erythropolis П3-8, обладающего высокой амидазной и карбоксилэстеразной активностью, для энантиоселективного гидролиза N-ацетил и N-бензоил производных 3,4-дигидро-3-метил-2H-[1,4]бензоксазина и 2-метил-1,2,3,4-тетрагидрохинолина (схема 1).
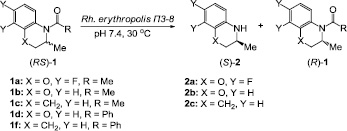
Схема 1. Энантиоселективный микробиологический гидролиз N-ацил производных 3,4-дигидро-3-метил-2H-[1,4]бензоксазина и 2-метил-1,2,3,4-тетрагидрохинолина
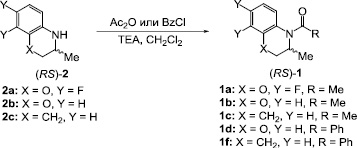
Схема 2. Синтез исходных амидов (RS)-1a-f
Материалы и методы исследования
В данной работе мы исследовали новый штамм микроорганизмов, выделенный из лесной подзолистой почвы пригорода г. Перми, который был отнесен к виду Rhodococcus erythropolis по совокупности культурально-морфологических, хемотакстономических и биохимических признаков, а также по результатам секвенирования генов 16S рРНК. Исследуемая культура обладает следующими морфологическими характеристиками: грамположительные клетки формируют на плотных средах колонии среднего размера, округлые, не сливные, розовато-кремовые, матовые, поверхность слегка морщинистая, профиль изогнутый (с центральной точкой), консистенция колоний молодой культуры – мягкая, старых – творожистая, на минимальном агаре колонии круглые с ризоидным краем.
Культуры выращивали на минеральной солевой среде (г/л): KH2PO4 – 1,0; K2HPO4×3H2O – 1,6; NaCl – 0,5; MgSO4×7H2O – 0,5; CaCl2 – 0,005; CoCl2×6H2O – 0,01; FeSO4×7H2O – 0,005; рН 7,2 ± 0,2. Агаризованную среду получали добавлением бактоагара (Sigma) до конечной концентрации 1,5 %. Источником углерода служила глюкоза в конечной концентрации 0,1 %. В качестве субстрата использовали амиды (RS)-1a-f, которые служили единственными источниками азота. Ростовые субстраты асептически добавляли до конечной концентрации в автоклавированную и охлажденную до 25 °С среду. Чистота культур контролировалась высевом на агаризованную среду LB. Плотность культуры оценивали по изменению оптической плотности суспензии клеток при 540 нм с учетом разведения на спектрофотометре СФ-46 с использованием кварцевой 1 см кюветы. Одна единица оптической плотности при 540 нм соответствует 0,42 мг сухого веса клеток [1].
Исходные амиды (RS)-1a-f получали по стандартным методикам из соответствующих аминов (RS)-2a-c при взаимодействии с уксусным ангидридом или бензоил хлоридом в присутствии триэтиламина (Схема 2) [13]. Выходы целевых продуктов составляли 62–74 %. Строение и химическую чистоту синтезированных соединений подтверждали данными спектроскопии ЯМР, элементного анализа и тонкослойной хроматографии.
Исследование биотрансформации амидов (RS)-1a-c в зависимости от времени инкубации под действием Rh. erythropolis П3-8 (25 мг) проводили при 30 °С и перемешивании 90 об/мин в растворе 0,25 мл ДМСО и 24,75 мл фосфатного буфера (pH 7,4) с начальной концентрации амида (RS)-1a-c 100 мкг/мл (0.440 ммоль/л для 1a, 0,523 ммоль/л для 1b и 0,528 ммоль/л для 1c) в течение семи дней. Через каждые сутки отбирали аликвоту 2 мл, смесь продуктов реакции экстрагировали 1 мл дихлорметана, сушили над MgSO4.
Исследование биотрансформации амидов (RS)-1d,f под действием Rh. erythropolis П3-8 проводили при 30 °С и перемешивании 90 об/мин в растворе 0,5 мл ДМСО и 49,5 мл фосфатного буфера (pH 7,4) с начальной концентрации амида (RS)-1d,f 50 мкг/мл (0,197 ммоль/л для 1d и 0,199 ммоль/л для 1f) в виду плохой растворимости субстратов вусловиях реакции. На 3, 5 и 7 сутки отбирали аликвоту 2 мл, смесь продуктов реакции экстрагировали 1 мл дихлорметана, сушили над MgSO4.
Изменение концентрации и энантиомерный состав образующихся продуктов гидролиза определяли на хроматографе Knauer Smartline-1000 (Германия) на колонке Chiralcel OD-H (250×4,6 мм, 5 мкм), скорость элюирования 1 мл/мин; детектирование при 230 нм. Состав подвижной фазы и времена удерживания продуктов в смеси представлены в таблице. В качестве примера на рис. 1 приведена типичная хроматограмма смеси амина (RS)-2a и амида (RS)-1a.
Состав подвижной фазы и времена удерживания амидов 1a-f и аминов 2a-c
|
Амид |
Амин |
Подвижная фаза |
(R)-амин τ, мин |
(S)-амин τ, мин |
(R)-амид τ, мин |
(S)-амид τ, мин |
|
(RS)-1а |
(RS)-2а |
гексан–iPrOH 40:1 |
12,3 |
16,0 |
22,6 |
49,9 |
|
(RS)-1b |
(RS)-2b |
гексан–iPrOH 100:1 |
18,1 |
19,9 |
25,7 |
39,9 |
|
(RS)-1c |
(RS)-2c |
гексан–iPrOH–MeOH 100:1:1 |
6,6 |
7,4 |
9,5 |
10,7 |
|
(RS)-1d |
(RS)-2b |
гексан–iPrOH–MeOH 100:1:1 |
12,1 |
13,4 |
20,7 |
23,2 |
|
(RS)-1f |
(RS)-2c |
гексан–iPrOH–MeOH 100:0.8:0.2 |
10,0 |
11,2 |
26,4 |
30,25 |
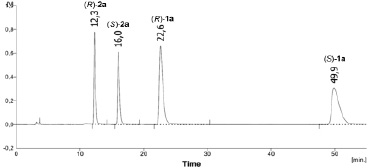
Рис. 1. Типичная хроматограмма смеси амина (RS)-2a и амида (RS)-1a (Chiralcel OD-H, гексан–iPrOH 40:1, скорость потока 1,0 мл/мин, детектирование при 230 нм)
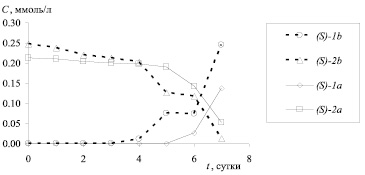
Рис. 2. Зависимость концентрации (C, ммоль/л) амидов (S)-1a,b и аминов (S)-2a,b от времени биотрансформации (начальная концентрация амидов (RS)-1a,b 100 мкг/мл)
Для отнесения времени удерживания (R)- и (S)-энантиомеров амидов 1a-f и аминов 2a-c были синтезированы индивидуальные (S)-энантиомеры аминов 2a-c методом кинетического разделения при ацилировании хлорангидридом (S)-напроксена или N-фталоил-(S)-фенилаланина, как описано ранее [7, 15]. Из (S)-энантиомеров аминов 2a-c были получены (S)-энантиомеры амидов 1a-f.
Результаты исследования и их обсуждение
В течение всего процесса биотрансформации N-ацетил производных 3,4-дигидро-3-метил-2H-[1,4]бензоксазинов (RS)-1a,b не было зафиксировано образование соответствующих аминов (R)-2a,b. Следовательно, (R)-энантиомеры амидов 1a,b не подвергаются биохимической трансформации, и их количество может служить внутренним стандартом для определения концентраций (S)-энантиомеров амидов 1a,b и аминов 2a,b. Кинетика стереоселективного гидролиза приведена на рис. 2.
В случае амида (RS)-1a биотрансформация начинается только на 6 сутки, на 7 сутки происходит резкое изменение концентрации исходного субстрата. В случае гидролиза амида (RS)-1b наблюдается 2 резких изменения концентраций продукта и субстрата на 5 и 7 сутки биотрансформации, что может быть обусловлено активацией различных ферментов, входящих в состав микроорганизма.
Для биотрансформации N-ацетил-2-метил-1,2,3,4-тетрагидрохинолина (RS)-1c штамм Rh. erythropolis П3-8 оказался непригоден, за 7 суток проведения реакции не наблюдалось появления продукта реакции и изменения концентрации энантиомеров субстрата.
Для гидролиза N-бензоил производных (RS)-1d,f штамм Rh. erythropolis П3-8 оказался слишком активным. В случае амида (RS)-1d биотрансформации подвергались оба энантиомера субстрата, причем одновременно, с получением в результате рацемического амина 2b, что свидетельствует о неселективности штамма в отношении данного амида.
В случае амида (RS)-1f наблюдали не только полную трансформацию субстрата в продукт, но и дальнейшую трансформацию продукта, а также появление большого количества примесей неустановленного строения.
Заключение
Таким образом, нами найден новый штамм микроорганизмов рода Rhodococcus erythropolis для эффективной биотрансформации N-ацил производных аминов. Показано, что результат микробиологической трансформации существенным образом зависит как от строения гетероцикла, так и природы ацильной группы субстрата. Установлено, что в результате микробиологического гидролиза N-ацетил производных фторированного и нефторированного 3,4-дигидро-3-метил-2H-[1,4]бензоксазина биотрансформации подвергаются только (S)-амиды с образованием соответствующих (S)-аминов (ee > 99 %). N-Ацетил-2-метил-1,2,3,4-тетрагидрохинолин не подвергался биотрансформации.
Микробиологический гидролиз N-бензоилпроизводных 3,4-дигидро-3-метил-2H-[1,4]бензоксазина и 2-метил-1,2,3,4-тетрагидрохинолина штаммом Rhodococcus erythropolis П3-8 проходил нестереоизбирательно, биотрансформации подвергались оба энантиомера субстрата.
Результаты данного исследования могут быть полезными для промышленного производства (S)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина – ключевого полупродукта в синтезе высокоактивного противобактериального препарата левофлоксацин.
Работа выполнена в рамках темы (проекта) государственного задания на 2018 г. № государственной регистрации АААА-А18-118020290144-8.
Библиографическая ссылка
Чулаков Е.Н., Левит Г.Л., Садретдинова Л.Ш., Ремезовская Н.Б., Максимов А.Ю., Демаков В.А., Краснов В.П. ИСПОЛЬЗОВАНИЕ НОВОГО ШТАММА АКТИНОБАКТЕРИЙ RHODOCOCCUS ERYTHROPOLIS П3-8 В ЭНАНТИОСЕЛЕКТИВНОМ ГИДРОЛИЗЕ N-АЦИЛ ПРОИЗВОДНЫХ 3,4-ДИГИДРО-3-МЕТИЛ-2H-[1,4]БЕНЗОКСАЗИНА И 2-МЕТИЛ-1,2,3,4-ТЕТРАГИДРОХИНОЛИНА // Успехи современного естествознания. – 2018. – № 10. – С. 22-27;URL: https://natural-sciences.ru/ru/article/view?id=36876 (дата обращения: 18.04.2024).



