С целью обеспечения санитарных, гигиенических показателей, предъявляемых к питьевой, бытовой, технической воде, технологическим жидкостям, решения экологических проблем проводится обеззараживание вод различного назначения хлором.
После операции хлорирования обязателен контроль содержания остаточного активного хлора. Под термином «активный хлор» понимают суммарное содержание в воде сильных хлорсодержащих окислителей: гипохлорита натрия, молекулярного растворенного хлора и хлорамина. Основная часть анализов остаточного активного хлора выполняется традиционным химическим методом, в основе которого – методика объемного титрования рабочим раствором тиосульфата натрия с визуальной индикацией точки эквивалентности по крахмалу. Главными недостатками методики являются малая химическая устойчивость растворов тиосульфата натрия, необходимость периодической проверки его титра, высокий предел определяемых содержаний активного хлора и соответственно низкая чувствительность метода, относительно большая ошибка определения. Систематическая ошибка йодид-крахмальной методики определения остаточного активного хлора составляет около 8 отн % при САХ = 0,3–0,7 мг/л и уменьшается до 4 отн % при САХ = 1,5 мг/л. Как известно, с целью устранения указанных недостатков объемного классического анализа, автоматизации метода, сокращения его трудоемкости проводятся исследования по разработке инструментальных методов контроля активного хлора.
Электрохимическая, особенно анодная обработка (активация) водных растворов электролитов нашла достаточно широкое применение на стадиях пробоподготовки в алгоритме различных электрохимических и других физико-химических методов анализа [5].
Целью нашей работы является разработка методики определения активного хлора электрохимически обработанной жидкости косвенно потенциометрическим методом.
Материалы и методы исследования
Электрохимическая генерация активного хлора в растворах хлорида натрия (с содержанием соли от 0,001 до 1,0 моль/дм3) проводилась в анодной камере двухкамерного проточного электролизера с электродами в виде графитовых дисков в режиме постоянного и импульсного тока (силой от 0,05 до 0,5 А, соответствующий интервал плотности тока от 8 до 70 А/м2). Формирование окислительно-восстановительного потенциала в этих условиях контролировалось потенциометрическими измерениями (индикаторный точечный платиновый электрод ЭПВ-1, хлоридсеребряный электрод сравнения ЭВЛ 1 МЗ) как в потоке анолита, фрагмент которого образует гальваническую ячейку, так и в пробоотборнике при перемешивании магнитной мешалкой.
Результаты исследования и их обсуждение
Аналитический контроль за содержанием «активного хлора» (mАХ или САХ, мг/дм3 или моль/дм3) в электрохимически обработанной жидкости – анолите осуществлялся методом йодометрического титрования с визуальной индикацией конечной точки титрования в соответствии с ГОСТ 18190-72 [1]. В отличие от данной стандартной методики нами на анализ отбирался в несколько раз меньший объем жидкой пробы.
Методика определения активного хлора объемным йодометрическим титрованием. 0,5–1,0 г сухого йодистого калия вносят в коническую колбу емкостью 100 см3, растворяют его в 1–2 см3 дистиллированной воды, затем добавляют 1 см3 буферного раствора с рН равным 4,5 и 25 см3 анолита или соответствующего модельного раствора. Выделившийся йод титруют раствором тиосульфата натрия с концентрацией С(Na2S2O3) = 0,005 моль/дм3 до появления светло-желтой окраски. После чего прибавляют 1 см3 0,5 % раствора крахмала и титруют до исчезновения синей окраски.
Массовую долю активного хлора (mАХ, мг/дм3) рассчитывали по формуле
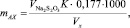 (1)
(1)
где 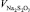 – количество 0,005 Н раствора тиосульфата натрия, израсходованное на титрование, см3; K – поправочный коэффициент нормальности раствора тиосульфата натрия; 0,177 – содержание активного хлора, соответствующее 1 см3 0,005 Н раствора тиосульфата натрия; V – объем пробы воды, взятый для анализа, см3; 1000 – коэффициент для перевода массы в граммах в миллиграммы.
– количество 0,005 Н раствора тиосульфата натрия, израсходованное на титрование, см3; K – поправочный коэффициент нормальности раствора тиосульфата натрия; 0,177 – содержание активного хлора, соответствующее 1 см3 0,005 Н раствора тиосульфата натрия; V – объем пробы воды, взятый для анализа, см3; 1000 – коэффициент для перевода массы в граммах в миллиграммы.
Молярную концентрацию активного хлора в анолите, САХ, моль/дм3, рассчитывали по формуле
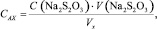 (2)
(2)
где V(Na2S2O3) – общий объем Na2S2O3, пошедший на титрование (до к.т.т.), см3; VX – объем анолита на анализ, см3.
Другой метод количественного определения активного хлора в электрохимически обработанном растворе (анолите) с различным содержанием хлористого натрия – косвенный потенциометрический метод без проведения титрования («одноточечное» ОВ-титрование), основанный на измерении двух значений окислительно-восстановительного потенциала E(I2/2I–) в обратимой (равновесной) электрохимической йод-йодидной системе с Pt-индикаторным электродом: после смешения пробы с реагентом (КI) (Е1) и после добавки дозы эталонного (фиксанального) раствора йода (Е2). Первоначальное выделение в испытуемой смеси (Е1) обусловлено реакцией активного хлора (окислитель) с йодид-ионами.
В литературе опубликованы различные варианты подобного определения для контроля остаточных количеств «активного хлора» в питьевых, производственных и сточных водах. Потенциометрическое же определение «активного хлора» в электрохимически обработанных хлоридсодержащих электролитах на основе потенциалов E(I2/2I–) до настоящей работы, по-видимому, не проводилось. Как уже отмечалось выше, обратимые потенциалы E(I2/2I–) являются к тому же важной характеристикой окислительно-восстановительных свойств электрохимически обработанной жидкости.
Согласно теоретическому анализу, проведенному в работах [3], в системе I2–KI–NaCl протекают следующие основные объемные равновесные реакции:
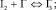 (3)
(3)
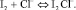 (4)
(4)
На поверхности платинового электрода локализуются электрохимические реакции:
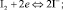 (5)
(5)
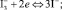 (6)
(6)
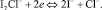 (7)
(7)
Так как указанное выделение йода в данных экспериментальных условиях происходит при значительном избытке солей NaCl и KI, концентрацию йода С(I2) в испытуемом растворе можно описать общим уравнением
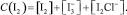 (8)
(8)
C учетом равновесий всех реакций (3)–(7) окислительно-восстановительный потенциал исследуемой системы выразим уравнением Нернста для электрохимической реакции (6). Выразив концентрацию 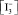 из уравнения (8) при условии, что
из уравнения (8) при условии, что
[I–] ≅ C(KI); (9)
[Сl–] ≅ C(NaCl), (10)
находим
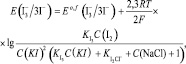 (11)
(11)
где 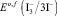 – формальный потенциал реакции (6);
– формальный потенциал реакции (6); 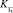 – концентрационная константа образования комплекса
– концентрационная константа образования комплекса  [4];
[4]; 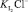 – концентрационная константа образования частицы I2Cl– [4].
– концентрационная константа образования частицы I2Cl– [4].
Принимая во внимание относительно высокую ионную силу испытуемого раствора из уравнения (11), получаем
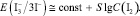 (12)
(12)
Соотношение (12) удовлетворительно согласуется с экспериментальными данными: опытная зависимость э.д.с. гальванического элемента от lg C(I2) является линейной в интервале значений С(I2) = 2•10–4–10–2 моль/дм3. Отсюда найдено среднее экспериментальное значение крутизны электродной функции S = 29,9 мВ. Таким образом, приведенные результаты подтверждают возможность применения косвенного потенциометрического метода определения активного хлора без проведения титрования в электрохимически обработанном солевом растворе.
Методика определения активного хлора электрохимически обработанной жидкости косвенно потенциометрическим методом
50 см3 раствора анолита помещают в химический стакан емкостью 100 см3, вносят 0,5 г сухого йодистого калия, после его растворения измеряют первое значение окислительно-восстановительного потенциала Е1. Затем вносят добавку 1 см3 стандартного (фиксанального) раствора йода с концентрацией С(I2) = 0,1 моль/дм3 и измеряют второе значение окислительно-восстановительного потенциала Е2. Находят разность потенциалов
ΔЕ = Е2 – Е1. (13)
Содержание активного хлора САХ, моль/дм3, рассчитывают по формуле
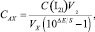 (14)
(14)
где С(I2) – концентрация фиксанального раствора йода, моль/дм3; 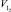 – объем стандартной добавки йода, см3; VX – объем анолита на анализ, см3; S – крутизна электродной функции, мВ.
– объем стандартной добавки йода, см3; VX – объем анолита на анализ, см3; S – крутизна электродной функции, мВ.
Для оценки содержания активного хлора по величине массовой доли mAX, мг/дм3, значения САХ умножаем на 0,0355.
Результаты определения активного хлора в анолите проточного двухкамерного электролизера при различных режимах электролиза методами йодометрического титрования и косвенной потенциометрии приведены в табл. 1 и 2.
Полученные результаты 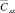 представляются вполне достоверными, так как имеется удовлетворительное согласие между методами йодометрического титрования и косвенной потенциометрии: по критерию F более чем половина результатов, из представленных в табл. 1, 2 проб анолита, по t-критерию установлено почти полное отсутствие значимой систематической ошибки [2].
представляются вполне достоверными, так как имеется удовлетворительное согласие между методами йодометрического титрования и косвенной потенциометрии: по критерию F более чем половина результатов, из представленных в табл. 1, 2 проб анолита, по t-критерию установлено почти полное отсутствие значимой систематической ошибки [2].
При условии 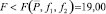 величину t-критерия оценивали по формуле
величину t-критерия оценивали по формуле
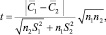 (15)
(15)
где n1 = n2 = 3, С1 и С2 – средние значения 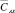 по результатам химического и электрохимического анализов.
по результатам химического и электрохимического анализов.
Таблица 1
Результаты определения массовой доли «активного хлора» в образцах анолита проточного двухкамерного электролизера методом йодометрического титрования (n = 3; P = 0,95; tp = 4,30)
|
№ п/п |
Условия электролиза |
|
S, мг/дм3 |
102•Sr |
|
|
I, A |
w, см3/мин |
||||
|
1 |
0,1 |
6,0 |
2,32 ± 0,33 |
0,13 |
5,60 |
|
2 |
0,1 |
25,0 |
4,35 ± 0,35 |
0,14 |
3,20 |
|
3 |
0,1 |
2,0 |
5,89 ± 0,94 |
0,38 |
6,50 |
|
4 |
0,1 |
2,0 |
7,25 ± 0,55 |
0,22 |
3,00 |
|
5 |
0,2 |
25,0 |
7,25 ± 0,55 |
0,22 |
3,00 |
|
6 |
0,2 |
25,0 |
9,29 ± 0,17 |
0,07 |
0,75 |
|
7 |
0,1 |
2,0 |
9,37 ± 0,45 |
0,18 |
1,90 |
|
8 |
0,1 |
4,0 |
9,59 ± 0,19 |
0,08 |
7,90 |
|
9 |
0,1 |
25,0 |
12,08 ± 0,07 |
0,03 |
0,25 |
|
10 |
0,4 |
4,0 |
13,03 ± 0,34 |
0,13 |
1,00 |
|
11 |
0,4 |
25,0 |
14,38 ± 0,94 |
0,38 |
2,60 |
|
12 |
0,2 |
2,0 |
18,99 ± 0,89 |
0,36 |
1,90 |
|
13 |
0,1 |
25,0 |
19,20 ± 1,51 |
0,61 |
3,20 |
|
14 |
0,4 |
2,0 |
22,28 ± 0,69 |
0,28 |
1,30 |
|
15 |
0,2 |
2,0 |
31,38 ± 1,56 |
0,63 |
2,00 |
|
16 |
0,4 |
4,0 |
44,69 ± 2,35 |
0,95 |
2,10 |
Таблица 2
Результаты определения массовой доли «активного хлора» в образцах анолита проточного двухкамерного электролизера методом косвенной потенциометрии (без титрования). Условия электролиза (табл. 1) (n = 3; P = 0,95; 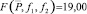 ; tр = 4,30)
; tр = 4,30)
|
№ п/п |
|
S, мг/дм3 |
102•Sr |
F |
t |
|
1 |
2,54 ± 0,38 |
0,15 |
5,90 |
1,15 |
1,83 |
|
2 |
4,31 ± 1,22 |
0,49 |
1,14 |
12,00 |
0,14 |
|
3 |
5,11 ± 0,50 |
0,35 |
7,00 |
1,23 |
2,62 |
|
4 |
7,52 ± 1,74 |
0,70 |
9,30 |
9,80 |
0,64 |
|
5 |
8,86 ± 2,31 |
0,93 |
10,50 |
17,20 |
2,90 |
|
6 |
8,86 ± 2,31 |
0,93 |
10,50 |
172,00 |
0,80 |
|
7 |
9,40 ± 2,32 |
0,93 |
10,00 |
17,20 |
0,06 |
|
8 |
9,40 ± 2,32 |
0,93 |
10,50 |
143,00 |
0,35 |
|
9 |
11,36 ± 2,78 |
1,12 |
9,80 |
140,00 |
1,08 |
|
10 |
13,08 ± 4,38 |
1,76 |
13,50 |
163,00 |
0,05 |
|
11 |
14,11 ± 4,35 |
1,75 |
12,40 |
2,06 |
0,22 |
|
12 |
18,18 ± 6,63 |
2,67 |
14,70 |
16,50 |
0,53 |
|
13 |
18,18 ± 6,63 |
2,67 |
14,70 |
19,20 |
0,65 |
|
14 |
22,32 ± 9,13 |
3,67 |
16,40 |
168,00 |
0,02 |
|
15 |
30,26 ± 7,42* |
4,40 |
14,50 |
49,40 |
4,42 |
|
16 |
47,85 ± 14,82* |
8,78 |
18,30 |
86,75 |
0,62 |
Примечание. *) Р = 0,90; tp = 2,92.
При условии 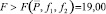 величину t-критерия оценивали по формуле
величину t-критерия оценивали по формуле
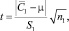 (16)
(16)
принимая, что результаты химического анализа С2 ближе всего к истинному значению концентрации m(АХ). Как следует из табл. 1, 2, условие электролиза (сила тока, скорость потока электролита) существенно не влияют на результаты определения САХ.
Заключение
Таким образом, предложенный в настоящей работе вариант косвенного потенциометрического метода определения общего содержания «активного хлора» без применения буферной системы дает вполне достоверные данные о САХ в электрохимически (анодно) обработанных хлоридсодержащих водных растворах с рН около 1,5–3,5 (образование HСl).
Данный метод может использоваться контрольно-аналитическими службами, что позволит значительно снизить трудоемкость анализа определения остаточного активного хлора и повысит чувствительность методики.
Библиографическая ссылка
Баранова Е.И. КОСВЕННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ «АКТИВНОГО ХЛОРА» // Успехи современного естествознания. – 2016. – № 11-1. – С. 9-13;URL: https://natural-sciences.ru/ru/article/view?id=36175 (дата обращения: 23.04.2024).




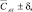 мг/дм3
мг/дм3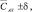 мг/дм3
мг/дм3