Рассеянный склероз (РС) является воспалительным, аутоиммунным демиелинизирующим заболеванием нервной системы, в генезе которого отмечают наличие наследственных факторов, перенесенных инфекций и травм, иногда – гормональных нарушений, беременности, токсических воздействий. Течение заболевания прогрессирующее, с определенной непредсказуемостью, приводящее вначале к ограничению трудоспособности, а затем – к инвалидности [2, 4, 7].
По распространённости РС различают зоны высокого риска – более 50 случаев, среднего риска – от 10 до 50 случаев, низкого риска – менее 10 случаев на 100000 населения. За последнее время отмечен отчетливый рост распространённости PC в большинстве стран Европы и отдельных регионов России [1, 5]. Исследование, проведенное в Томске (М.А. Титова, 2012), позволило отнести Томскую область к зоне среднего риска по распространенности рассеянного склероза. В 2010 году распространенность составила 27,11 на 100 тыс. населения (стандартизованный на европейское население показатель 23,96 на 100 тыс.). При сравнении с распространенностью РС в Томской области в 1980 году (22,0 случая на 100 тыс. населения) автор отмечает прирост этого показателя в 1,2 раза. Основными факторами риска развития РС в изученной популяции являлись: рождение второго и последующих по счету детей в семье; контакт с нефтепродуктами, органическими растворителями, красками, ядохимикатами, кислотами и щелочами, металлами, бензином, радиацией после 15 лет; наличие в анамнезе инфекций – кори, тонзиллита, кариеса зубов; раннее проявление синусита и герпетической инфекции [1]. Увеличение числа новых случаев РС в большинстве стран – и в первую очередь в РФ – следует связать с улучшением качества диагностики после внедрения магнитно-резонансной томографии, что позволило выявлять его на ранних стадиях [2, 4, 5]. Причем с появлением МРТ появилась возможность не только ранней диагностики, но оценки эффективности проводимой терапии. Чувствительность метода настолько высока, что некоторые исследователи относят его к оптимальным методам диагностики [11].
В настоящее время перспективным направлением в лечении РС является профилактика прогрессирования болезни и инвалидизации трудоспособных пациентов. С этой целью используются иммуномодулирующие препараты, достоверно снижающие частоту обострений и скорость прогрессирования РС [2, 3, 4, 12]. К ним относятся β-интерфероны, в частности β-интерферон-1а (в России зарегистрирован как «Ребиф», с предполагаемым наряду с иммуномодулирующим антипрофилиративным и противовирусным действием) и единственный на сегодняшний день препарат копаксон, обладающий иммуномодулирующими свойствами и способностью блокировать миелин-специфические аутоиммунные реакции, участвующие в патогенезе разрушения миелиновой оболочки нервных проводников ЦНС при рассеянном склерозе [15].
Цель исследования – оценка изменений очагов повреждения и их динамика по данным МРТ на фоне проводимой терапии вышеперечисленными иммуномодуляторами.
Материалы и методы исследования
Обследовано 39 пациентов с достоверным диагнозом рассеянного склероза, в соответствии с критериями Ч. Позера и соавт. (C.M. Poser et. al. 1983), подтвержденными данными МРТ головного мозга. Для оценки тяжести неврологического дефицита использовалась расширенная шкала инвалидизации Куртцке (Expanded Disability Status Scale или EDSS) [13]. Пациенты первой группы в составе 24 человек получали лечение препаратом копаксон (ТЕВА, Израиль). Продолжительность лечения была различная: в течение одного года терапию получали все пациенты этой группы, два года лечения закончили только 10 человек. Лечение препаратом Ребиф (Сероно, Италия) проводилось у 15 человек в течение одного года. Средний возраст пациентов, принимающих копаксон, составил 32,45 ± 1,7 (от 17 до 49 лет), среди них 10 мужчин (40 %), 14 женщин (60 %). Средний балл по шкале Куртцке на начало лечения был 2,86 ± 1,14, Возраст больных, получавших ребиф, составил в среднем 33,28 ± 1,91 лет (от 16 до 47 лет), из них 7 мужчин (46,6 %) и 8 женщин (53,4 %), средний балл по шкале EDSS составил к началу терапии 3,71 ± 0,19. МРТ головного мозга проводилась в лаборатории НИИ кардиологии г. Томска и включала в себя получение аксиальных и сагиттальных срезов в режиме спин-эхо по Т1 и по Т2. Исследования выполнялись на низкопольном МР-томографе Magnetom-Open (Siemens Medical) с напряженностью магнитного поля 0,2 Т. По необходимости, с целью оценки обострения процесса использовалось контрастирование парамагнетиком в стандартных дозах (магневист, омнискан – 0,2 мл на кг\веса). У всех больных проводили подсчет количества очагов на Т2 взвешенных изображениях до лечения, через год и два года от начала лечения, с расчетом физического объема повреждения (ФОП) головного мозга на Т2 взвешенных изображениях. Эта величина рассчитывалась по сумме объемов всех выделенных зон повреждения мозга (областей усиленного Т2)
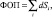
где d – толщина среза, а Si – площадь пораженного региона на срезе i.
Результаты исследования и их обсуждение
Данные анализа исследуемых МРТ-признаков в группе больных, получающих копаксон в течение двух лет, показали уменьшение количества Т2 гиперинтенсивных очагов. До лечения их было (в среднем) 9,3 ± 4,0, через два года их среднее количество равнялось 7,11 ± 3,4. Изменения ФОП ткани не достигали статистически значимых. При сравнении этих показателей до лечения и через год от начала лечения в группе больных, получающих Ребиф, была выявлена тенденция к уменьшению количества очагов и объема поражения белого вещества на Т2 взвешенных изображениях (таблица).
На рис. 1 представлена типичная картина формирования очагов при рассеянном склерозе и отражена их динамика через год после терапии ребифом.
Динамика МРТ-показателей при лечении ребифом
|
МРТ-показатель |
До лечения ребифом |
Через год лечения ребифом |
|
Количество очагов на Т2 изображении |
7,3 ± 3,3 |
4,8 ± 2,0*∗ |
|
ФОП, см3 |
1,24 ± 1,08 |
0,63 ± 0,3*∗ |
а б
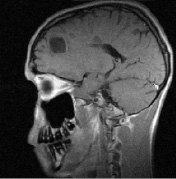
в г
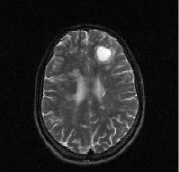
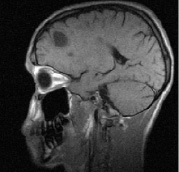
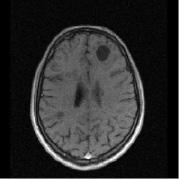
Рис. 1. Больной К., 19 лет, с диагнозом рассеянного склероза, исходные МР-томограммы до начала терапии ребифом: аксиальное Т2 (а), и сагиттальное Т1 (б) – сечение до контрастирования; в, г – после контрастирования омнисканом. На аксиальных Т2 и Т1 сечениях видны множественные очаги демиелинизации, один из которых с формированием полости с очерченной капсулой в лобной доле слева. Большинство очагов расположены перивентрикулярно, захватывают белое вещество, отмечается и прикортикальное их расположение. Вовлечены мозолистое тело, ножки мозга и мозжечка. На рис. в, г после введения парамагнетика контраст не выраженно, но всё же накапливается на отсроченных томограммах, что указывает на определенную степень активности процесса (б – до введения омнискана; в – на 7 минуте исследования; г – спустя 20 мин после введения). Более четкое включение контраста имеется в ножках мозга, по краю валика мозолистого тела
Патологические изменения по данным МРТ наблюдались у всех больных, отвечающих диагностическим критериям рассеянного склероза. При использовании последовательности «инверсия – восстановление» или на T1 взвешенных изображениях изменения из-за слабой интенсивности сигнала выявлялись хуже. Характерные для рассеянного склероза изменения лучше видны на Т2 взвешенных изображениях с последовательностью «спиновое эхо» на средневзвешенных изображениях, либо с использованием FLAIR последовательностей. Очаги повышенной интенсивности хорошо были заметны на фоне окружающих тканей головного мозга, обычно они были связаны со стенками латеральных желудочков, затрагивали мозолистое тело и белое вещество. Такое перивентрикулярное расположение наиболее соответствует очагам демиелинизации, характерным для рассеянного склероза. Реже очаги обнаруживаются в стволе мозга, мозжечке и спинном мозге. В отличие от большинства цереброваскулярных заболеваний – при рассеянном склерозе патологические изменения часто выявляются в мозолистом теле.
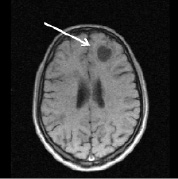
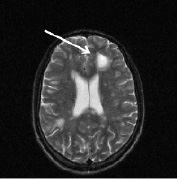
а б
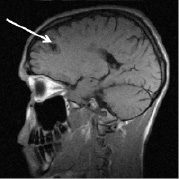
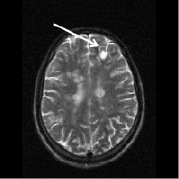
в г
Рис. 2. Больной К., 19 лет. Три месяца (а, б) и шесть месяцев (в, г) спустя после назначения ребифа. Несмотря на то, что клинически отмечалось улучшение общего самочувствия больного, а на томограммах выявлялась положительная динамика в виде уменьшения диаметра и площади основного очага в левой лобной доле, определяется изменение интенсивности и миграция очагов перивентрикулярно у правого переднего рога бокового желудочка по сранению с исходной картиной (рис. 1, a). Такие изменения подтверждают факт сохранения активности процесса, его римиттирующего течения и оправдывают проведение дальнейшей терапии (стрелкой отмечен основной очаг и его динамика)
По данным литературы, очаги демиелинизации, или разряжения, гиперинтенсивные в Т2 последовательности, обнаруживаются в 95 % случаев РС. Если же MPT выявляет наличие очагов у больных с «вероятным рассеянным склерозом» (в случае клинически изолированного синдрома), то в 65 % случаев они являются предикторами развития достоверного рассеянного склероза в течение ближайших 5 лет. Размер типичных для рассеянного склероза очагов обычно составляет 6 мм и более. Эти очаги можно обнаружить перивентрикулярно, в мозолистом теле, в стволе мозга, мозжечке, спинном мозге и в зрительных нервах. Выявление гиперинтенсивных очагов в нескольких зонах головного мозга в Т2 режиме отражает полифокальность неврологического поражения при рассеянном склерозе [16].
В наших наблюдениях более 90 % очагов выявлялись перивентрикулярно, в мозолистом теле и в белом веществе. Изменения, характерные для рассеянного склероза, в половине случаев определялись в ножках мозжечка и самом мозжечке. Стволовые структуры – ножки мозга, мост, продолговатый мозг до уровня краниовертебрального перехода повреждались реже – примерно в трети случаев.
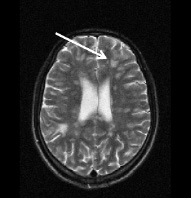
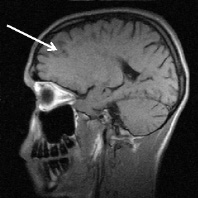
а б
Рис. 3. Тот же больной К.: a – аксиальное Т2; б – сагиттальное Т1 сечения, спустя год от начала терапии. Выраженная положительная динамика по сравнению с исходными очагами (рис. 2) и последующими (через 3 и шесть месяцев) томограммами без контрастирования. В левой лобной доле остаточный очаг до 6 мм с исходом в глиоз с разряжением в центре. Сохраняются более мелкие перивентрикулярные очаги и очаги прикортикального расположения, лучше различимые в Т2 последовательности, для которых сохраняется определенная наклонность к миграции (очаг глиоза в левой лобной доле помечен стрелкой)
По современным представлениям, для подтверждения диагноза рассеянного склероза используются МРТ критерии, соотнесенные с возрастом. Для больных до 50 лет диагноз рассеянного склероза считается весьма вероятным при обнаружении у больного на Т2 взвешенных изображениях четырех или более очагов, или трех очагов, один из которых расположен перивентрикулярно (диаметр очагов не менее 3–5 мм). Для возрастной категории старше 50 лет вводятся два дополнительных критерия – диаметр очагов не менее 3–5 мм, при этом один или несколько очагов примыкают к стенке бокового желудочка и один или несколько очагов имеются в структурах головного мозга задней черепной ямки [2, 9].
В клинической практике нашли отражение и диагностические МРТ критерии рассеянного склероза по F.H. Fazekas – это наличие не менее трёх очагов, два из которых располагаются перивентрикулярно и их размер должен быть более 6 мм, или один очаг может располагаться субтенториально [2, 10, 14]. Для более детального описания рассеянного склероза используются критерии по F. Barkhof с соавт. [8], согласно которым очаги должны соответствовать 3 из 4 условий: первое – один очаг, накапливающий контраст, или 9 гиперинтенсивных очагов в Т2 режиме; второе – наличие как минимум одного субтенториального очага; третье – один или несколько очагов должны располагаться вблизи коры головного мозга; четвертое – должно быть не менее трёх перивентрикулярных очагов.
В целом эффективность лечения рассеянного склероза обычно оценивается по снижению частоты обострений и замедлению темпа наступления инвалидности. Однако обострения при рассеянном склерозе во многих случаях не очень часты, а при первично-прогрессирующем рассеянном склерозе их вовсе нет. Кроме того, как в определении обострений рассеянного склероза, так и в оценке степени нарастания инвалидности пациента есть определенная субъективность, по-разному определяемая врачом. С этих позиций оправдано проведение повторных МРТ исследований, в том числе и спинного мозга, при ухудшении состояния пациента и появлении новых жалоб с использованием парамагнетика.
Вместе с тем следует помнить, что при наличии клинического невыраженного обострения явного включения препарата в очаги может и не быть, особенно если не выдержаны соотношения дозы препарата и веса больного, т.е. случаи, когда контраст вводится в недостаточном объёме. Даже там, где тщательно соблюдена технология введения, очаги накапливают контраст не всегда. Так, у обследованных нами больных, отчетливое накопление контраста было только у 4-х пациентов. У 16-ти человек оно было сомнительным, не позволяющем утверждать о достоверном накоплении. Поэтому важно учитывать не только контрастирование, но и появление новых очагов повреждения, отсутствующих ранее, их размеры и миграцию, косвенно указывающих на обострение. С этой точки зрения, МРТ проведенное в динамике, как показано на рисунках выше, позволяет объективизировать результаты лечения, для чего бывает достаточной оценка всего двух параметров: числа новых очагов, выявленных в Т2 режиме и их общей площади, а также появления очагов, накапливающих контраст в Tl режиме.
Выводы
МРТ-исследования у больных, получающих иммуномодулирующую терапию копаксоном и ребифом, показали снижение распространенности процесса и уменьшение объема поражения белого вещества головного мозга, что вероятно связано с положительным терапевтическим эффектом этих препаратов. Проводимое контрастирование парамагнетиком может не давать указаний на обострение в течение основного заболевания и в то же время не исключает его наличия, если появляются новые очаги и их миграция. Магнитно-резонансная томография, проведенная в Т2 и Т1-IR и FLAIR последовательностях, может выступать в качестве контрольного метода на этапах терапии РС, позволяющего оценивать характер изменений в веществе головного мозга как исходно, так и на фоне проводимой терапии. В ряде случаев дополнительные сведения удается получить и при использовании PD-взвешенных последовательностей и спектроскопии, что больше характерно для высокопольных систем.



