Начальные этапы развития лимфатического русла с целью выяснить происхождение первичных лимфатических сосудов подробно изучали в начале XX века, причем главным образом на животном материале. В наиболее известных работах F. Sabin [8] и O.Kampmeier [6] использовались эмбрионы свиньи. Широко известная «Эмбриология человека» Б.М.Пэттена [2] включает иллюстрации с препаратов свиньи, в т.ч. по вопросам развития лимфатической системы. F. Lewis [7] исследовал эмбрионов кролика и т.д. И это понятно: свежий эмбриональный материал в большом количестве да еще с последовательным и подробным, поэтапным развитием у человека очень трудно получить, если вообще возможно, а в сжатые сроки – невозможно. Cовременные исследования с применением стволовых клеток и методов экспрессии генов как раз проводятся на эмбрионах млекопитающих и птиц [4, 5, 10-13], но также приводят к диаметрально противоположным выводам о венозном и мезенхимном происхождении лимфатического эндотелия.
Я изучил сопоставимые начальные стадии развития лимфатической системы у эмбрионов ряда животных и нашел, что субкардинальный венозный синус и забрюшинный лимфатический мешок имеют разные размеры, которые коррелируют с размерами первичных почек. С этих позиций можно составить следующий эволюционный ряд эмбрионов в убывающем порядке: свинья → овца → человек → белая крыса [1]. Но при этом морфогенез забрюшинного лимфатического мешка и гистогенез его стенок протекают в эмбриогенезе млекопитающих разных видов сходным образом. Поэтому я решил проиллюстрировать венозное происхождение лимфатического эндотелия [9] на эмбрионах свиньи и овцы в дополнение к ранее опубликованным моим материалам по эмбриогенезу человека.
Цель исследования: показать однотипность и преемственность эндотелиальной выстилки венозных карманов и последующих лимфатических щелей на примере морфогенеза забрюшинного лимфатического мешка у свиньи и овцы.
Материалы и методы исследования
10 эмбрионов свиньи и 10 эмбрионов овцы 8-26 мм теменно-копчиковой длины (ТКД, 4-я – 5-я нед) были фиксированы в жидкости Буэна. Возраст эмбрионов я определял по таблицам Б.П. Хватова и Ю.Н. Шаповалова [3], хотя в случае эмбрионов овцы это было затруднительно, т.к. в таблицах указывается возраст зародышей, только начиная с 18-22 мм ТКД (1 месяц). После фиксации эмбрионы были залиты в парафин с последующим изготовлением их серийных срезов толщиной 5-7 мкм в трех основных плоскостях. Срезы были окрашены гематоксилином и эозином, альциановым синим (рН = 2,0-3,0) в комбинации с ШИК-реакцией (контроль – гидроксиламин, амилаза), толуидиновым синим (рН = 1,0-5,0; контроль – тестикулярная гиалуронидаза), а также импрегнированы нитратом серебра по Карупу на ретикулярные волокна соединительной ткани.
Результаты исследования и их обсуждение
У эмбрионов свиньи и овцы 13-14 мм ТКД (4-я нед) краниальный интерсубкардинальный анастомоз резко расширяется между почками и надпочечниками, становится субкардинальным венозным синусом. Тонкие эндотелиальные стенки синуса при этом сильно деформируются: местами их участки вместе с артериями мезонефроса, которые обладают гораздо более толстыми стенками и адвентициальной оболочкой, и с межсосудистой соединительной тканью инвагинируют в просвет синуса. Инвагинации разных размеров расчленяют периферическую часть субкардинального синуса, прежде всего в его дорсальном отделе, на полиморфные венозные карманы. У эмбрионов свиньи и овцы 16-20 мм ТКД (конец 1-го мес) субкардинальный венозный синус разделяется на две части: 1) центральная часть с магистральным кровотоком и тонкой адвентициальной оболочкой – ствол левой почечной вены и почечная часть задней полой вены; 2) периферическая часть в виде скопления полиморфных лимфатических щелей с очень тонкой эндотелиальной выстилкой – закладка забрюшинного лимфатического мешка. У эмбрионов 5-й нед межщелевые перегородки истончаются и разрываются. В результате образуется и расширяется крупная полость забрюшинного лимфатического мешка, который окружает ствол левой почечной вены и прилегающую часть задней полой вены. Мешок имеет тонкие эндотелиальные стенки. Дольше сохраняются те более толстые межщелевые перегородки, покрытые тонким эндотелием, в которых сохраняются артерии мезонефроса. Первичные почки на данном уровне дегенерируют, а с ними – и большинство их артерий, кроме тех, которые преобразуются в артерии дефинитивных органов, например почек, или их закладок, например, артерии тел Цукеркандля.
Строение сосудистого русла у изученных эмбрионов свиньи и овцы не вполне совпадает с таковым у эмбрионов человека с такой же ТКД. Видовые особенности строения зародышей носят скорее количественный характер. Это в т.ч. относится к первичным почкам, субкардинальному венозному синусу и забрюшинному лимфатическому мешку, достигающих наибольших размеров у эмбрионов свиньи. Дегенерация ее громадных мезонефросов и канализация (путем слияния лимфатических щелей) закладки забрюшинного лимфатического мешка протекают медленнее, чем у человека. У овечьих эмбрионов определяется промежуточное состояние. Для иллюстрации текста этой статьи я выбрал срезы эмбрионов свиньи и овцы 20 мм ТКД, у которых завершается обособление венозных карманов от центрального канала субкардинального синуса с магистральным кровотоком и на их месте определяется скопление лимфатических щелей – закладка забрюшинного лимфатического мешка (рис. 1-2). Карманы, щели и мешок имеют тонкую эндотелиальную выстилку с примерно одинаковыми толщиной и строением.
А Б В
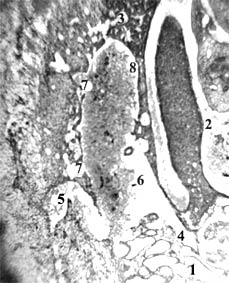
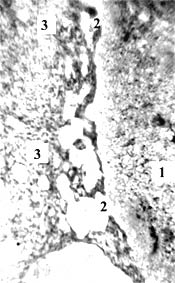
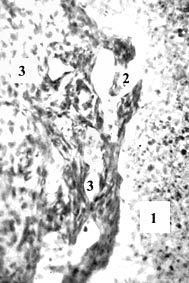
Рис. 1. Эмбрион свиньи 20 мм длины (1 месяца), сагиттальный срез. А: 1 – мезонефрос; 2 – гонада; 3 – печень; 4,5 – субкардинальная и супракардинальная вены; 6 – субкардинальный венозный синус; 7-7 – дорсальная часть субкардинального синуса разделена на венозные карманы, они отшнуровываются с образованием лимфатических щелей; 8 – задняя полая вена. Б, В: 1-3 – субкардинальный венозный синус, его венозные карманы, в т.ч. отделившиеся как лимфатические щели с эндотелиальной выстилкой. Гематоксилин и эозин. Ув.: А – 50; Б – 120; В – 300
А Б
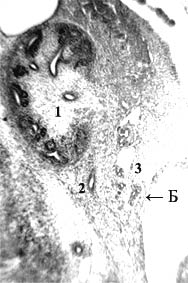
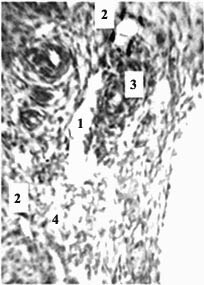
Рис. 2. Эмбрион овцы 20 мм длины (1 месяца), сагиттальный срез. А: 1 – почка; 2 – мочеточник; 3 – латеральная часть закладки забрюшинного лимфатического мешка. Б: 1 – эндотелиальная выстилка формирующегося забрюшинного мешка; 2 – лимфатические щели с эндотелиальной выстилкой, еще не вошедшие в состав забрюшинного мешка; 3 – крупная, ветвящаяся инвагинация артерии мезонефроса с окружающей соединительной тканью в полости забрюшинного мешка, где видны истончающиеся и прерывающиеся перегородки (4). Гематоксилин и эозин. Ув.: А – 50; Б – 250
Заключение
Эндотелиальная выстилка субкардинального венозного синуса и его карманов, образующихся из них лимфатических щелей и забрюшинного лимфатического мешка у эмбрионов свиньи и овцы имеет одинаковые толщину и строение, эндотелий левой почечной вены (из центральной части субкардинального синуса) – большую толщину, клеточные ядра размещены в нем более часто. Поэтому я делаю вывод, что лимфатический эндотелий возникает из эндотелия той части первичного венозного русла, которая выключается из кровотока в конце первого месяца эмбриогенеза свиньи и овцы путем образования венозных карманов и последующего их обособления в виде лимфатических щелей. Щели затем сливаются в лимфатические мешки. Дифференциация лимфатического и венозного эндотелиев, судя по их толщине и строению, происходит по градиенту кровяного давления. Эти параметры еще больше у эндотелия артерий, как и артериальное давление.
Библиографическая ссылка
Петренко В.М. ПРОИСХОЖДЕНИЕ ЛИМФАТИЧЕСКОГО ЭНДОТЕЛИЯ. II. ЭМБРИОГЕНЕЗ МЛЕКОПИТАЮЩИХ ЖИВОТНЫХ // Успехи современного естествознания. – 2014. – № 4. – С. 39-41;URL: https://natural-sciences.ru/ru/article/view?id=33318 (дата обращения: 24.04.2024).



