Разработка и экспериментально-клиническая апробация остеопластических имплантационных материалов, обладающих биоактивностью, биосовместимостью, остеоиндуктивностью и остеокондуктивностью остается одной из наиболее актуальных проблем современной медицины [3, 8]. Для остеозамещения используют различные материалы как биологического происхождения, так и синтетические [3, 4, 5]. Наиболее часто применяют: деминерализованный костный матрикс, биокерамику, коллагеновые матриксы и криогели, биостекла и биоситаллы, аналоги костного минерала – гидроксиапатит, трикальций фосфат, а также полисахариды природного происхождения [5, 6]. Однако при изучении отдаленных результатов установлено, что эти имплантаты не остеоинтегрируются, а окружаются фиброзной капсулой, вне зависимости от того, использовали плотный или пористый материал [7]. Недостатками их являются также низкая остеоиндуктивная и остеопластическая эффективность, отсутствие остеокондуктивной активности, они ограниченно биосовместимы.
Цель работы – изучение особенностей репаративного остеогенеза при замещении дефекта кости в условиях имплантации аллогенного минерализованного костного матрикса (МКМ).
Материалы и методы исследования
Эксперименты выполнены на 50 половозрелых крысах линии Wistar обоего пола с массой тела 340-390 г. Содержание, эксперименты и эвтаназию животных выполняли в соответствии с правилами Европейской конвенции защиты позвоночных животных, использующихся в экспериментальных и других научных целях и одобрены этическим комитетом РНЦ «Восстановительная травматология и ортопедия им. акад. Г.А. Илизарова». Были сформированы 2 группы животных по 25 крыс в каждой – контрольная и подопытная. Животных той и другой группы содержали в одинаковых условиях вивария на стандартном рационе. В условиях операционной с использованием общей анестезии (рометар 8 мг и золетил 4 мг на 1000 г массы тела внутримышечно) на границе проксимальной трети диафиза и метафиза большеберцовых костей у животных контрольной и подопытной групп осуществляли моделирование несквозных окончатых дефектов диаметром 2,5-3 мм, с проникновением в костномозговую полость, путем односторонней перфорации кортикального слоя кости зубным бором. Животным подопытной группы непосредственно после операции в область сформированного дефекта вводили стерильный биоматериал – гранулированный МКМ массой 2-3 мг, полученный из аллогенных трубчатых костей, не минерализованные органические компоненты которых удаляли с помощью 6 % раствора гипохлорита натрия (NaOCl), с последующим измельчением до порошкообразного состояния [2]. Через 2, 5, 7, 14 и 21 суток животных выводили из эксперимента (использовали по 5 животных на каждую временную точку). Большеберцовые кости фиксировали в 2% растворе параформальдегида и глутаральдегида на фосфатном буфере при рН 7,4, заливали в парафин (после декальцинации) и в аралдит (без декальцинации). Парафиновые срезы окрашивали гематоксилином – эозином и пикрофуксином по Ван-Гизону. Аралдитовые блоки исследовали при помощи рентгеновского электронно-зондового микроанализатора INCA-200 Energy (Oxford instruments, Англия), сканирующего электронного микроскопа JSM-840 (Jeol, Япония) и трансмиссионного электронного микроскопа JEM -2010 (Jeol, Япония). Активность костеобразовательного процесса определяли по содержанию в регенерате костной ткани и неминерализованных компонентов. По отношению этих показателей рассчитывали индекс компактности регенерата, характеризующий интенсивность костеобразования и степень зрелости новообразованной костной ткани, в которой определяли также содержание остеоида и минерализованного матрикса. Результаты количественных исследований обрабатывали методами вариационной статистики. Значимость различий сравниваемых параметров рассчитывали с использованием критерия Стьюдента. Различия считали значимыми при уровне Р < 0,05.
Результаты исследования и их обсуждение
Имплантируемые гранулы МКМ имеют размер 50-200 мкм в поперечнике и упорядоченную высокопористую структуру, строение их поверхности характеризуется резко выраженной шероховатостью и фрактальностью с размером зерна в нанодиапазоне. Они обладают наноструктурированностью, множеством макро- и микропор неправильной формы размером 10-20 мкм, некоторые из пор имеют размеры менее 100 нм. Поры соответствуют местам локализации костных лакун и костных канальцев, из которых клетки и другие органические компоненты были удалены при получении имплантата. Результаты исследований, выполненных нами ранее, свидетельствуют, что химический состав и микроархитектоника гранул МКМ соответствуют составу и строению естественного костного матрикса [1]. Гистологические исследования показали, что через 2-5 суток после операции в обеих группах животных в зоне повреждения выявляются альтеративно-деструктивные изменения, и возникает острая воспалительная реакция. Обнаруживаются очаги организованной гематомы, со сгустками фибрина, малодифференцированными клеточными элементами, нейтрофильными гранулоцитами, макрофагами, тучными клетками и экстравазальными эритроцитами и лимфоцитами. Выявляются лейкоцитарно-некротические массы, содержащие лизированные клетки и пласты фибрина. Клеточные элементы воспаления и осколки кости, образовавшиеся при операции, формируют центрально расположенный очаг воспаления, на месте которого к 7 суткам развертываются восстановительные процессы, наблюдается репаративное костеобразование по типу интрамембранного остеогенеза и формируется регенерат, постепенно заполняющий перфорационную полость (рис. 1).
Через 7 суток после операции в регенерате животных контрольной группы четко выделяются две зоны – периферическая и центральная. В периферической зоне наблюдается новообразование грубоволокнистой костной ткани в виде единичных тонких трабекул и небольших костно-остеоидных островков (рис. 1, а), репаративное костеобразование при этом развивается от периферии к центру. В центральной зоне регенерата наблюдается малодифференцированная соединительная ткань с признаками отека, содержащая немногочисленные кровеносные сосуды, экссудат и клеточный детрит. В подопытной группе животных через 7 суток после операции в периферической зоне регенерата формируется обширная мелко петлистая сеть утолщенных трабекул, покрытых рядами многочисленных остеобластов, формирующих губчатое костное вещество, тесно спаянное с поверхностью компактного вещества (см. рисунок, б), в центральной зоне регенерата выявляются многочисленные костные трабекулы, остеобластические и фибробластические элементы и значительное количество расширенных и заполненных кровью сосудов.
У животных подопытной группы клетки воспалительной реакции не выявляются, репаративное костеобразование в регенерате формируется по всему поперечнику дефекта. Вокруг гранул МКМ определяются зоны активного неоангиогенеза и аппозиционного костеобразования (рисунок, в). В этих участках отсутствуют геморрагии и очаги деструкции, отмечается активная пролиферация фибробластов и преостеобластов, на поверхности имплантированных гранул МКМ формируется слой остеогенных клеток, остеоида и костного матрикса.
а б
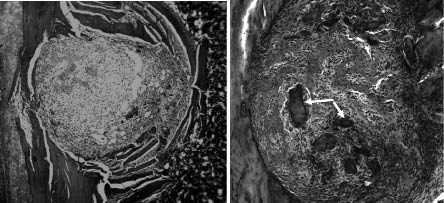
в г
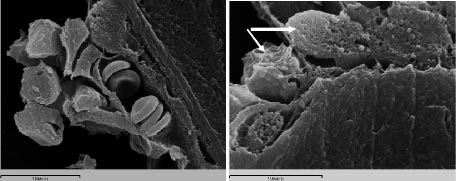
д
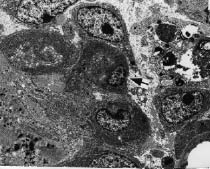
Строение регенерата, формирующегося в перфорационной полости большеберцовых костей крыс через 7 (а, б, в) и 14 (г, д) суток после операции: а – в контрольной группе – костно-остеоидные трабекулы формируются лишь на периферии регенерата; б – в подопытной группе – костные трабекулы заполняют всю перфорационную полость. Стрелки – имплантированные гранулы минерализованного костного матрикса. Окраска гематоксилином – эозином. Объектив 10, окуляр 10; в – в подопытной группе – капиллярные почки и периваскулярные остеогенные клетки на поверхности имплантированной гранулы МКМ; г, д – остеобласты (стрелки) и остеоцит на поверхности гранулы МКМ; в, г – сканирующая электронная микроскопия, д –трансмиссионная электронная микроскопия. Увеличение х 5000
Через 14 и 21 сутки после операции у подопытной группы животных в регенерате наблюдается фаза органогенеза и ремоделирования, о чем свидетельствует перестройка первичных трабекул в органотипические остеонные структуры и многочисленность спайных линий. По краю дефекта определяются массивные напластования новообразованной костной ткани, которая по степени кальцификации приближается к неповрежденному кортикальному слою. В регенерате часто обнаруживаются характерного строения лакуны остеоцитов, одной из стенок которых является поверхность имплантированных гранул МКМ (рисунок, г). Пустые лакуны остеоцитов немногочисленны. Вокруг имплантата располагаются функционально активные остеобласты и широкий слой остеоида тонковолокнистой костной ткани (рисунок, д). Среди трабекул пластинчатой костной ткани видны замурованные в костную ткань остатки гранул МКМ, образовавшихся при биодеструкции и остекластической резорбции, внутри них обнаруживаются функционально активные остеокласты с многочисленными ядрами и инвагинациями щеточной каемки, контактирующие с поверхностью гранул. Это свидетельствует, о том, что темп биодеградации имплантата соответствует скорости новообразования костной ткани. Через 21 сутки после операции большинство пор имплантированных гранул МКМ заполняется остеогенными клетками, формирующими костную ткань внутри имплантата, что обеспечивает приобретение им остеогенных свойств. У животных контрольной группы формирование тканеспецифического регенерата кости в области дефекта происходит медленнее и в более поздние сроки, через 21 сутки после операции наблюдается лишь постепенное преобразование балок грубоволокнистой костной ткани в более минерализованные и зрелые.
Количественные исследования показали (таблица), что через 7 суток после операции объем костной ткани (как остеоида, так и минерализованного матрикса) в регенерате животных подопытной группы увеличивается почти в 2 раза по сравнению с контрольными показателями (Р<0,01). Индекс компактности увеличивается с 0,09±0,001 в контрольной группе до 0,21±0,002 в подопытной (Р<0,001), что свидетельствует об увеличении степени зрелости новообразованной костной ткани в подопытной группе животных. Через 14 и 21 сутки после операции объем костной ткани в регенерате существенно возрастает в обеих группах, но наиболее значительно – в подопытной группе животных (Р<0,01). Индекс компактности в этот период составляет: через 14 суток – 1,35±0,06 в контроле и 2,31±0,1 в опыте (Р<0,01); через 21 сутки – 5,80±0,20 в контроле и 12,7±0,5 в опыте (Р<0,001).
Доля различных компонентов в составе регенерата, формирующегося в перфорационной полости большеберцовых костей крыс в контрольной и подопытной группах (M ± m, %)
|
Исследованные компоненты |
Срок после операции, сут |
|||||
|
7 |
14 |
21 |
||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
|
|
Неминерализованные компоненты Остеоид Минерализованный матрикс кости |
91,4± 4,3 2,4± 0,1 6,2± 0,2 |
82,1± 4,1* 5,6± 0,2* 12,3± 0,5* |
42,5± 2,1 11,4± 0,5 46,1± 2,2 |
30,2± 1,4* 18± 0,9* 51,8± 2,3* |
14,7± 0,7 17± 0,8 68,3± 3,3 |
7,3± 0,3* 19,3± 0,9* 73,4± 3,5* |
* Значимые изменения по сравнению с контрольными показателями.
Проведенные исследования показали, что величина коэффицента Са/Р в имплантируемых гранулах МКМ составляет 1,97±0,11, что по данным литературы [3, 4, 5], свидетельствует о том, что минеральный компонент МКМ, как и матрикс интактных костей имеет лабильную структуру поверхностного слоя из аморфного апатита. Образование в биологической среде организма этого поверхностного карбонатапатитного слоя на порах гранул МКМ, обладающего более выраженной, по сравнению с натуральной костью, интенсивностью обмена ионов, обеспечивает аффинитет к костной ткани регенерата, ее врастание, плотный контакт с поверхностью имплантируемых гранул и образование остеоинтегративного соединения. Известно, что в минерализованном матриксе костной ткани локализованы факторы роста и костные морфогенетические белки, являющиеся эффективными остеоиндукторами, которые выделяются при естественном ремоделировании кости, травматическом повреждении и патологическом процессе [3, 5, 9, 10]. Следовательно, отмеченная нами постепенная пролонгированная остеокластическая резорбция имплантированных гранул МКМ обеспечивает им свойства остеоиндуктора и наиболее благоприятные условия для адгезии, пролиферации, дифференцировки и функционирования остеогенных клеток, чему способствует шероховатость и наноструктурированность поверхности имплантата.
Заключение
Таким образом, при имплантации в зону дефекта кости гранулированного МКМ наблюдается пролонгированная активизация репаративного костеобразования, глубокое прорастание костной ткани в имплантат, ускоряется процесс ремоделирования регенерата и сокращаются сроки заживления поврежденной кости. Относительная атравматичность оперативного вмешательства (гранулированный МКМ можно вводить путем инъекций), простота технологии заготовки и консервации имплантационного материала [1], остеокондуктивные и остеоиндуктивные свойства, характерный темп биодеградации, соответствующий скорости репаративного костеобразования, отсутствие биологической реакции отторжения ставят исследованный биоматериал в ряд наиболее оптимальных костнопластических материалов, особенно в условиях уменьшения индивидуального остеогенетического потенциала у пациентов зрелого и пожилого возраста. Полученные количественные данные доказали, что применение имплантата из гранулированного МКМ в качестве стимулятора репаративного остеогенеза теоретически обосновано и перспективно и может быть использовано, в частности, при лечении дефектов костей, образовавшихся в результате остеомиелитических секвестров, костных кист, очагов остеонекроза и онкологических заболеваний.
Библиографическая ссылка
Ирьянов Ю.М., Кирьянов Н.А., Дюрягина О.В. ВЛИЯНИЕ МИНЕРАЛИЗОВАННОГО КОСТНОГО МАТРИКСА НА РЕПАРАТИВНЫЙ ОСТЕОГЕНЕЗ // Успехи современного естествознания. – 2014. – № 4. – С. 24-28;URL: https://natural-sciences.ru/ru/article/view?id=33315 (дата обращения: 16.04.2024).



