Разработка и изучение систем контролируемой доставки фармацевтических препаратов на основе биодеградируемых полимерных мембран является одним из наиболее перспективных и быстро развивающихся направлений химической технологии [10]. В настоящее время выделяющие лекарственные вещества материалы в основном используются для покрытия хирургических имплантатов или как перевязочные материалы. Такие материалы, как правило, содержат:
1) матрицу в виде волокон или непрерывного полимера;
2) терапевтически активное вещество, размещенное в матрице;
3) вспомогательное вещество которое либо способствует связыванию терапевтически активного вещества с матрицей, либо, наоборот, способствует его высвобождению.
Основное преимущество систем контролируемой доставки фармацевтических препаратов заключается в возможности длительного поддержания стационарного уровня фармацевтического препарата в тканях или биологических жидкостях в течение необходимого для терапии времени. Эффективность систем с контролируемой доставкой фармацевтических препаратов во многом определяется свойствами материалов, из которых изготовлена матрица, свойствами терапевтически активного вещества и свойствами вспомогательного вещества [7]. В целом системы контролируемой доставки фармацевтических препаратов кроме необходимых физико-химических и механических свойств (высокая сорбционная способность, эластичность, газопроницаемость, стабильность и т.п.) должны быть атравматичными, биосовместимыми, биодеградируемыми. Перспективным материалом для получения систем с контролируемой доставкой фармацевтических препаратов является хитозан [9].
Рис. 1. Химическая формула хитозана
Хитозан – это полиаминосахарид, состоящий из случайно связанных β-(1-4) D-глюкозаминовых звеньев и N-ацетил-D-глюкозамина. Получают хитозан только из хитина, в чистом виде он в природе не встречается [2]. Хитозан содержит в себе большое количество свободных аминогрупп, что позволяет ему связывать и прочно удерживать различные катионы [5]. Хитозан способен образовывать большое количество водородных связей, поэтому он может связать не только металлы, но и большое количество органических водорастворимых веществ [7]. Сам по себе хитозан плохо растворим в воде, так как в ней происходит протонирование аминогрупп, что затрудняет его растворение, при этом он довольно хорошо растворяется в неорганических кислотах [2]. В органических кислотах содержащих несколько карбоксильных групп, хитозан не растворяется, поскольку данные кислоты образуют межмолекулярные сшивки [5]. Хитозан может удерживать в своей структуре как растворитель, так и растворенные в нём вещества [7]. В данной статье будет рассмотрено решение проблемы связанной с наличием кислоты в составе хитозана. Кроме того, хитозан может частично связывать жирорастворимые соединения за счет эффекта молекулярного сита и гидрофобных взаимодействий [9]. Для хитозана характерны мукоадгезивные свойства, то есть способность к прилипанию к слизистым оболочкам. Данные свойства хитозана активно используются при создании лекарственных форм, поступающих в организм через слизистые оболочки. В настоящее время хитозан и его производные с успехом используются для доставки лекарств через нос, слизистые мембраны глаз, а также ротовую полость. Благодаря своей катионной природе, хитозан способен образовывать нерастворимые полиэлектролитные комплексы с анионными полимерами [2]. Эта способность используется в технологиях капсулирования, в том числе при направленной радионуклидной терапии [1]. Нужно отметить, что при растворении в организме млекопитающих хитозан кроме описанных выше эффектов оказывает гипохолестеринемическое и дезинтоксикационное действие. Хитозан уменьшает уровень мочевой кислоты, холестерина и глюкозы в крови на фоне сахарного диабета, увеличивает эффективность усвоения кальция из пищи, обладает противогрибковыми и антибактериальными свойствами. На физиологическом уровне хитозан способствует усилению перистальтики кишечника, предотвращению всасывания жиров в тонком кишечнике, нормализации кишечной микрофлоры, более быстрому наступлению ощущения сытости после принятия пищи. За счет того, что хитозан обладает рядом уникальных свойств, его применяют в различных отраслях, например в сельском хозяйстве в качестве добавки в корма для животных, при изготовлении продуктов питания и косметики, а с недавнего времени и при создании продуктов биомедицины [5]. Нами создан ряд технологических решений получения биодеградируемых полимерных мембран и покрытий на основе хитозана высокой плотности с нужными механическими свойствами, однако принципиальная возможность создания на их основе систем контролируемой доставки фармацевтических препаратов до сих пор не подтверждена. Цель данной работы заключалась в исследовании кинетики высвобождения фармацевтического препарата линкомицина (антибиотик группы линкозамидов) (рис. 2) из биодеградируемых биополимерных мембран на основе хитозана высокой плотности. Принципиальная новизна представленной работы заключается в создании и исследовании биодеградируемой полимерной мембраны на основе хитозана высокой плотности, обладающей необходимыми механическими свойствами и способными без остатка высвобождать фармацевтический препарат линкомицин во временном интервале от 1 суток до 1 месяца.
Рис. 2. Химическая формула линкомицина
Уникальные свойства хитозана, а именно биосовместимость с тканями организма млекопитающих, бактериостатичность, способность усиливать регенерационные процессы, а также способность к пленкообразованию, предопределяют возможность использования хитозана в качестве покрытий хирургических имплантов. Нанесение его на поверхности имплантов способствует уменьшению вероятности послеоперационных осложнений. Одним из существенных преимуществ покрытий имплантов пленками на основе хитозана является их способность к ферментативному разложению. Такие биодеградируемые полимерные покрытия с лекарственными препаратами постепенно разрушаются в организме, при этом скорость высвобождения лекарственного препарата пропорциональна скорости биодеградации матрицы. В настоящее время известны несколько технологий получения биодеградируемых полимерных мембран и покрытий на основе хитозана высокой плотности с нужными свойствами [4, 6], однако даже основные закономерности высвобождения из них лекарственных препаратов до сих пор не изучены.
Мембраны на основе хитозана получали методом литья раствора полимера с последующим испарением растворителя. Приготовление 3 %-ных растворов высокомолекулярного хитозана (1000 кДа) (Sigma-Aldrich, США),) в 3 %-ном растворе соляной кислоты (Иреа 2000, Россия) проводили перемешиванием до гомогенного состояния в течение 1,5 ч при температуре раствора 40 °С. Для депонирования в мембрану лекарственного препарата в однородный раствор добавляли порошок антибиотика широкого спектра действия линкомицин гидрохлорид (Акрихин ХФК, Россия). Полученный раствор разливали в пластиковые формы размером 50*30 мм и заливали фиксирующим раствором (30 % этиловый спирт и 70 % аммиачная вода) на 20 минут. Водородный показатель раствора измеряли с помощью рН-мерт Эксперт-001 (Эконикс, Россия). По истечении этого времени фиксирующий раствор сливали и сушили пленки при 37 °С в течение 24 часов. Сухие пленки отмывали в фиксирующем растворе (50 мл на одну пленку) в течение 5 часов при комнатной температуре с последующей промывкой в дистиллированной воде, а затем в этиловом спирте. После отмывки пленки опять сушили при 37 °С в течение 24 часов. В итоге получаются пластичные мембраны содержащие линкомицин и имеющие толщину от 200 до 400 мкм.
Непосредственно перед экспериментом мембраны помещали в водные растворы для экстракции с разными значениями рН. Изучение кинетики высвобождения линкомицина из мембран на основе хитозана высокой плотности в раствор для экстракции проводили методом дифференциальной спектроскопии в видимой и ультрафиолетовой части спектра [9]. Измерения проводили в кварцевых кюветах с длиной оптического пути 1 см при помощи спектрофотометра Cary 100 (Varian, Австралия) [3]. Суть метода заключается в сравнении спектральных свойств двух растворов, отличающихся по одному признаку. В нашем случае проводили сравнение раствора, образующегося над хитозановой мембраной с антибиотиком, и раствора над хитозановой мембраной без антибиотика. Данный подход позволяет учесть влияние хитозана, который хоть и плохо, но также частично растворяется в водных растворах. Для контроля растворения хитозана высой плотности использовали сравнение раствора, образующегося над хитозановой мембраной, не содержащей антибиотик, и изначального раствора, в котором проходила экстракция веществ из мембран [9]. Для моментальных количественных оценок высвобождения антибиотика из мембран на основе хитозана высокой плотности было необходимо определить коэффициенты молярного поглощения линкомицина (рис. 3), мы приняли его за 8300 л/моль при 192 нм.
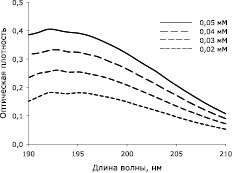
Рис. 3. Спектральные свойства растворов линкомицина в концентрациях (0,02–0,05 мМ) в фосфатно-солевом буфере (1 мМ; рН 7,4)
Исследовано влияние рН на высвобождение линкомицина из биодеградируемых биополимерных мембран на основе хитозана высокой плотности. В большинстве исследованных нами случаев скорость высвобождения линкомицина из биодеградируемых биополимерных мембран на основе хитозана высокой плотности зависит от значений рН (табл. 1, 2). Общей является следующая закономерность: чем ниже значение рН, тем быстрее идет высвобождение антибиотика. Так, для фильтра толщиной 200 мкм при рН 5,8 и при рН 9,0 динамика выхода линкомицина к 7 суткам отличается почти в 2 раза, для фильтра толщиной 400 мкм отличие – 1,5 раза. Необходимо отметить, что количество высвободившегося антибиотика за первые сутки в значительной мере не зависит от значений рН, это связано в первую очередь с краевыми эффектами, когда выход линкомицина в раствор не связан с растворением или разбуханием хитозана.
Таблица 1
Высвобождение линкомицина (0,9 мас %) из 200 мкм биодеградируемой биополимерной мембраны, созданной на основе хитозана высокой плотности, при разных значениях рН экстрагирующего водного раствора
|
Время, сутки |
Экстракция линкомицина, % |
|||
|
рН 5,8 |
рН 6,3 |
рН 7,4 |
рН 8,5 |
|
|
1 |
11,3 ± 0,9 |
13,3 ± 1,0 |
11,0 ± 1,0 |
11,2 ± 0,8 |
|
2 |
13,3 ± 1,1 |
17,1 ± 1,6 |
14,6 ± 1,2 |
11,2 ± 0,9 |
|
3 |
33,8 ± 2,1 |
41,4 ± 3,7 |
37,6 ± 2,4 |
25,0 ± 2,0 |
|
5 |
44,4 ± 3,6 |
50,8 ± 4,9 |
40,2 ± 3,1 |
27,6 ± 2,2 |
|
7 |
59,1 ± 3,9 |
57,1 ± 5,1 |
49,8 ± 4,5 |
29,5 ± 2,4 |
|
10 |
75,5 ± 3,8 |
66,1 ± 5,2 |
50,8 ± 4,0 |
34,8 ± 2,9 |
|
13 |
88,6 ± 4,2 |
80,2 ± 5,3 |
57,9 ± 4,3 |
35,7 ± 2,9 |
|
15 |
93,1 ± 1,9 |
83,7 ± 6,4 |
58,1 ± 4,4 |
35,7 ± 3,0 |
|
30 |
99,1 ± 0,3 |
93,8 ± 2,4 |
60,1 ± 4,5 |
36,8 ± 3,0 |
Исследовано влияние толщины биодеградируемых биополимерных мембран на основе хитозана высокой плотности на высвобождение из них линкомицина. При кислых рН 5,8 со вторых по тринадцатые сутки экстракции наблюдается следующая закономерность – чем толще мембрана, тем быстрее идет высвобождение. Так при рН 5,8 за двое суток из 200 мкм мембраны в раствор выходит линкомицина около 13 %, из из 400 мкм – 18 %, на пятые 44 % против 61 % и т.д. При более длительных временах экспонирования различие в скоростях экстракции исчезает, система приходит в состояние насыщения. При показателях рН от 6,3 до 8,5 не наблюдалось существенных различий в скорости экстракции линкомицина из мембран 200 и 400 мкм.
В целом кинетика выхода линкомицина из биодеградируемых биополимерных мембран на основе хитозана высокой плотности толщиной 200 и 400 мкм адекватно описывается экспоненциальным уравнением (Rise to Maximum) типа y = a(1 – e–bx). Нужно отметить, что данный тип уравнения при подгонке имеет корреляцию с реальными результатами не менее R2 = 0,96. Например, для формального описания кинетики выхода линкомицина из биодеградируемых биополимерных мембран на основе хитозана высокого давления толщиной 400 мкм при рН 5,8 параметр а = 100,43, b = 0,14, при этом R2 = 0,99.
Таблица 2
Высвобождение линкомицина (0,9 мас %) из 400 мкм биодеградируемой биополимерной мембраны, созданной на основе хитозана высокой плотности, при разных значениях рН экстрагирующего водного раствора
|
Время, сутки |
Экстракция линкомицина, % |
|||
|
рН 5,8 |
рН 6,3 |
рН 7,4 |
рН 8,5 |
|
|
1 |
9,8 ± 0,7 |
7,2 ± 0,5 |
6,3 ± 0,5 |
5,7 ± 0,5 |
|
2 |
18,7 ± 1,2 |
15,0 ± 0,9 |
10,3 ± 0,7 |
11,7 ± 0,5 |
|
3 |
48,9 ± 2,9 |
40,9 ± 2,8 |
29,3 ± 1,3 |
26,9 ± 0,5 |
|
5 |
60,8 ± 3,6 |
55,1 ± 3,2 |
50,2 ± 2,9 |
40,2 ± 0,5 |
|
7 |
72,1 ± 4,2 |
69,6 ± 3,9 |
60,7 ± 3,4 |
47,6 ± 0,5 |
|
10 |
80,2 ± 4,0 |
75,5 ± 3,9 |
67,3 ± 3,0 |
50,9 ± 0,5 |
|
13 |
89,6 ± 2,9 |
83,6 ± 3,7 |
68,0 ± 3,0 |
52,0 ± 0,5 |
|
15 |
95,0 ± 1,2 |
86,6 ± 3,7 |
68,3 ± 3,1 |
54,0 ± 0,5 |
|
30 |
99,0 ± 0,2 |
89,6 ± 3,8 |
69,1 ± 3,1 |
56,9 ± 0,5 |
Таблица 3
Высвобождение линкомицина (1,8 мас %) из 200 мкм биодеградируемой биополимерной мембраны, созданной на основе хитозана высокой плотности, при разных значениях рН экстрагирующего водного раствора
|
Время, сутки |
Экстракция линкомицина, % |
|||
|
рН 5,8 |
рН 6,3 |
рН 7,4 |
рН 8,5 |
|
|
1 |
7,1 ± 0,6 |
6,1 ± 0,4 |
5,8 ± 0,2 |
4,7 ± 0,3 |
|
2 |
18,9 ± 1,1 |
12,1 ± 0,9 |
9,7 ± 0,7 |
10,6 ± 1,3 |
|
3 |
36,3 ± 1,9 |
33,5 ± 2,0 |
22,1 ± 1,7 |
24,5 ± 1,8 |
|
5 |
56,8 ± 3,7 |
45,6 ± 3,5 |
39,9 ± 2,7 |
30,6 ± 2,6 |
|
7 |
66,7 ± 4,2 |
57,0 ± 3,9 |
55,0 ± 3,9 |
34,5 ± 3,3 |
|
10 |
78,4 ± 4,9 |
65,8 ± 4,7 |
56,6 ± 4,3 |
38,6 ± 3,2 |
|
13 |
89,9 ± 3,0 |
76,2 ± 4,2 |
57,6 ± 4,3 |
39,2 ± 3,8 |
|
15 |
93,9 ± 1,8 |
79,3 ± 3,9 |
57,7 ± 4,4 |
40,0 ± 3,6 |
|
30 |
99,9 ± 0,1 |
82,3 ± 4,1 |
59,3 ± 4,4 |
40,1 ± 3,6 |
Исследовано влияние концентрации линкомицина на его высвобождение из биодеградируемых биополимерных мембран на основе хитозана высокой плотности (табл. 1, 3). Показано, что изменение концентрации линкомицина в два раза, от 0,9 до 1,8 %, не оказывает существенного влияния на скорость его высвобождения.
Таким образом, в работе показано, что динамика высвобождения фармацевтического препарата линкомицина из биодеградируемых биополимерных мембран на основе хитозана высокой плотности слабо зависит от толщины мембран и концентрации антибиотика. Биодеградируемые биополимерные мембраны используемые в данном исследовании по техническим параметрам вполне пригодны для изготовления покрытий стентов и протезов с пролонгированным и контролируемым высвобождением лекарственных препаратов в окружающие ткани [8].
Работа выполнена при поддержке гранта РФФИ «14-29-10208-офи_м» и гранта РФФИ «16-08-01132-А».



