В настоящее время почти повсеместно наблюдается увеличение засоренности посевов сельскохозяйственных культур, причем 50–70 % посевных площадей засорено в сильной или очень сильной степени. Это связано в первую очередь с сокращением объема использования гербицидных препаратов и нарушением в комплексе противосорняковых мероприятий из-за экономических трудностей страны. Подсчитано, что потенциальные потери урожая в земледелии нашей страны от сорных растений за последние годы составили от 15,5 до 26,6 % для основных возделываемых культур. Общие потенциальные потери от сорняков составляют в пересчете на зерно ежегодно около 40 млн т. Каждый год на засоренных землях сорными растениями отчуждается около 12 млн т питательных веществ, что намного больше объема удобрений, которые вносятся на поля страны [2, 3]. В начале 2000-х гербицидами в Российской Федерации обрабатывалось около 15 млн га, что в 3,5 раза меньше по сравнению с применением гербицидов в последней пятилетке 1980-х. Однако в мире производство, применение и ассортимент пестицидов, в том числе и гербицидов, с каждым годом увеличивается [9, 12, 13, 15]. Потери урожая в России от сорняков весьма значительны и в последние годы составляют 15–18 % от урожая зерновых хлебов, а потери пропашных культур достигают 50 % и более [3, 11]. Снижение урожая на засоренных полях происходит из-за того, что сорняки отнимают у культурных растений свет, воду, питательные вещества. От затенения сорняками культурные растения особенно страдают в раннем возрасте, когда бурно развивающиеся сорняки опережают развитие культуры. Сорняки потребляют значительное количество воды и питательных веществ. Кроме непосредственно прямого уменьшения урожая вред сорняков также проявляется в снижении качества урожая, увеличении затрат на обработку почвы, очистку семян от семян и плодов сорняков, снижении выхода и качества продукции животноводства вследствие ухудшения качества засоренных пастбищ и сена и др. [3]. Методы борьбы с сорняками обычно принято подразделять на агротехнические, химические и биологические. Хотя такое деление не совсем корректно, так как и химические, и биологические методы борьбы также являются приемами агротехники. Эффективность применения гербицидов как одного из важнейших методов борьбы с сорняками подтверждена практикой отечественного земледелия, а их использование – необходимый агротехнический прием для получения высоких урожаев [8]. В настоящее время известно большое количество синтезированных гетероциклических систем с ярко выраженной гербицидной активностью, среди которых важное место занимают гетероциклические соединения с тремя и более гетероатомами в цикле. К ним относятся производные триазолинонов (карфентразон-этил), триазинонов (метрибузин), триазинов (атразин, прометрин), тиадиазинов (бентазон) и др. Также известно, что замещенные 1,2,3-триазолы до сих пор не нашли практического применения. Однако в этом ряду ведутся интенсивные поиски соединений с пестицидной активностью [3, 9]. В этой связи получение солей замещенных 1,2,3-триазолов как перспективных высокоактивных и малотоксичных гербицидных препаратов является актуальной задачей современной химии и гербологии.
Цель исследования – получение гидразиниевых и калиевых солей замещенных 4-динитрометил-1,2,3-триазолов и скрининговое изучение их биологической (гербицидной) активности.
Материалы и методы исследования
Спектры ИК снимали на спектрофотометре ИКС-29 в области частот 700–4000 см–1 в табл. KBr. Спектры ЯМР 1Н получали на спектрометре Bruker 400 (400 МГц) в растворе ДМСО-d6 относительно внутреннего стандарта – ТМС. Электронные спектры получены на спектрофотометре СФ-8 с автоматическим регистратором при комнатной температуре в водных растворах, концентрация веществ 0,4 мг/мл, толщина кюветы 0,0208 см. Масс-спектроскопические исследования проводили на хромато-масс-спектрометре Finnigan SSQ-7000 в режиме прямого ввода, энергия ионизирующих электронов 70 эВ, при температуре испарения образцов 90–150 °С.
Полученные в ходе реакции соединения выделяли и очищали методом адсорбционной хроматографии. В качестве адсорбента использовали силикагель марки Silicagel 100/400 µ. Хроматографическое разделение реакционной смеси проводили на нисходящей стеклянной колонке цилиндрической формы, заполненной «мокрым» способом при соотношении очищаемого вещества к сорбенту примерно 1:30. Размер хроматографической колонки при количестве вещества до 1,5 г : d = 10 мм, l = 250 мм; свыше 1,5 г : d = 10 мм, l = 500 мм. Продукты реакции после удаления растворителя переносили эфиром на небольшое количество силикагеля, обеспечивающее образование однородной сухой массы после удаления эфира. Силикагель с нанесенным веществом перемешивали с гексаном для удаления пузырьков воздуха и помещали в колонку поверх основного слоя чистого силикагеля. Для элюирования продуктов использовали элюотропный ряд по Траппе в следующей последовательности: четыреххлористый углерод, бензол, хлороформ, диэтиловый эфир, ацетон. Наблюдение за ходом разделения смеси проводили путем измерения показателя преломления, изменяющегося в ходе процесса. Индивидуальность полученных соединений подтверждали тонкослойной хроматографией (ТСХ) на пластинах Silufol UV-254 в системе растворителей ацетон: гексан 2:3, проявление парами йода.
Синтез 4-динитроэтоксикарбометил-1,2,3-триазолов (2-метил-4-динитроэтоксикарбометил-1,2,3-триазол (3), 1-метил-4-динитроэтоксикарбометил-1,2,3-триазол (4). Смешивали 4,5 г цианодинитроэтоксикарбонилметана (1) с избытком эфирного раствора диазометана (2). При хроматографировании реакционной смеси из фракции бензола получали 2,1 г (36 %) 2-метил-4-динитроэтоксикарбометил-1,2,3-триазола, nD20 1,4800. Найдено %: С 32,50; 32,51; Н 3,51; 3,52; N 26,88; 26,89. C7H9N5O6. Вычислено %: С 32,43; Н 3,48; N 27,02. Из фракции эфира получали 1,1 г (19 %) 1-метил-4-динитроэтоксикарбометил-1,2,3-триазола, Тпл 75 °С (CCl4). Найдено %: С 32,53; 32,54; Н 3,52; 3,53; N 26,90; 26,91. C7H9N5O6. Вычислено %: С 32,43; Н 3,48; N 27,02.
Получение солей 4-динитрометил-1,2,3-триазолов.
Калиевая соль 1-метил-4-динитрометил-1,2,3-триазола (5). К 0,9 г 1-метил-4-динитроэтоксикарбометил-1,2,3-триазола (4) прибавляли спиртовой раствор гидроксида калия. Осадок отфильтровывали, получали 0,7 г (80 %) калиевой соли 1-метил-4-динитрометил-1,2,3-триазола, Тпл 182 °С (этанол).
Калиевая соль 2-метил-4-динитрометил-1,2,3-триазола (6). К 0,9 г 2-метил-4-динитроэтоксикарбометил-1,2,3-триазола (3) прибавляли спиртовой раствор гидроксида калия. Осадок отфильтровывали, получали 0,6 г (70 %) калиевой соли 2-метил-4-динитрометил-1,2,3-триазола, Тпл 198 °С (этанол).
Гидразиниевая соль 2-метил-4-динитрометил-1,2,3-триазола (7). К 0,9 г 2-метил-4-динитроэтоксикарбометил-1,2,3-триазола (3) прибавляли по каплям при перемешивании спиртовой раствор гидразин-гидрата. Осадок отфильтровывали и подвергали хроматографированию, Тпл 142 °С.
Результаты исследования и их обсуждение
Получению солей замещенных 4-динитрометил-1,2,3-триазолов (5, 6, 7) предшествует синтез исходных соединений – алкилированных 4-динитроэтоксикарбометил1,2,3триазолов (3, 4) – продуктов 1,3-диполярного циклоприсоединения цианодинитроэтоксикарбонилметана (1) к диазометану (2). В этой реакции цианодинитроэтоксикарбонилметан выступает как активированный динитроэтоксикарбометильной группой диполярофил, а диазоалкан как 1,3-диполь. Вероятно, эта реакция протекает по схеме:
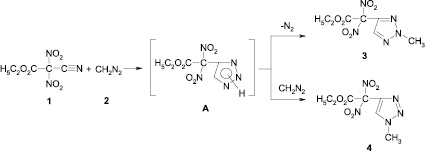
Обладая основными свойствами, молекула диазометана реагирует с протоном таутомерной, промежуточно образующейся смеси 1,2,3-триазолов (А) и возникающие при этом анионы триазола алкилируются катионом диазония, приводя к конечным продуктам реакции. Выделение изомерных соединений (3, 4) свидетельствует об амбидентности анионов 4-динитроэтоксикарбометил-1,2,3-триазолов. Преобладание среди синтезированных соединений изомера N2 (2) говорит о большей нуклеофильности этого атома азота и большей стабильности 2Н-таутомера, что согласуется с литературными данными [1,10], табл. 1.
Структура и изомерная принадлежность соединений (3, 4) установлена комплексным использованием методов ИК, ЯМР 1Н и 13С спектроскопии, масс-спектрометрии, химическими превращениями. ИК спектры соединений содержат интенсивные полосы валентных колебаний гем.-динитрогруппы 1580–1590 см–1 (антисимметричные) и 1300–1310 см–1 (симметричные), табл. 2.
Таблица 1
Физико-химические характеристики 4-динитроэтоксикарбометил-1,2,3-триазолов
|
Номер соединения |
Выход, % |
nD20 |
Тпл, ○С |
|
3 |
36 |
1,4800 |
– |
|
4 |
19 |
– |
75 |
Таблица 2
Спектры ЯМР 1Н и ИК 4-динитроэтоксикарбометил-1,2,3-триазолов
|
Номер соединения |
ИКС, ν, см–1, CHCl3 |
Спектр ЯМР 1Н |
||
|
NO2 |
CO2C2H5 |
δ, м.д. (CD3)2CO |
||
|
асим. |
сим. |
|||
|
3 |
1590 1580 |
1300 |
1765 1750 |
8,14 с (1Н, CH) 4.55 к (2H, CH2) 4,23 с (3Н, СН3) 1,32 т (3Н, СН3) |
|
4 |
1590 1580 |
1310 |
1770 1760 |
8,21 с (1Н, CH) 4,46 к (2H, CH2) 4,11 с (3Н, СН3) 1,29 т (3Н, СН3) |
Разность частот антисимметричного и симметричного валентных колебаний нитрогруппы (Δν) равна 280–290 см–1. Она приближена к Δν тринитрометильной группы, характерной для 4-тринитрометил-1,2,3-триазолов (Δν = 300 см–1), что, очевидно, связано с присутствием электроноакцепторной этоксикарбонильной группы. Поглощение в области 1770–1750 см–1 отнесено к валентным колебаниям сложноэфирной группы.
В спектрах ЯМР 1Н соединений (3, 4) (табл. 2) присутствуют сигналы соответствующих групп протонов. Важно было установить положение метильных заместителей в 4-динитроэтоксикарбометил-1,2,3-триазолах, т.е. идентифицировать изомеры. В спектрах ЯМР 1Н этих соединений аналитическим признаком служат сигналы протона у атома углерода С5 триазольного цикла. Различия в химических сдвигах протона у атома углерода С5 очень мало зависят от характера заместителя в триазольном цикле и составляют всего несколько десятых миллионной доли [4]. Из литературы для целого ряда изомерных 1,2,3-триазолов известно, что протон изомера, содержащий заместитель у атома N1, проявляется в более слабом поле по сравнению с изомером N2 [6, 14]. Этот факт позволил сделать отнесение соединений (3, 4) к N1 и N2 изомерам соответственно. Другим свидетельством в пользу принятого строения служит более слабопольное смещение сигнала протонов группы CH3–N для изомера N2, чем для изомера N1, что соответствует литературным сведениям [5].
Спектры ЯМР 13С также подтверждают структуру синтезированных соединений (табл. 3).
Анализ масс-спектров не противоречит произведенному отнесению изомеров. Как и в масс-спектрах других полинитрометанов, основным направлением распада молекулярных ионов этих соединений является отрыв одной из нитрогрупп с образованием ионов с m/z 213. Этот процесс протекает тем более легко, что образующийся ион хорошо стабилизирован за счет сопряжения карбокатионного центра с π-электронной системой триазольного цикла:
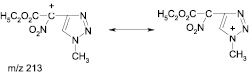
Таблица 3
Спектры ЯМР 13С 4-динитроэтоксикарбометил-1,2,3-триазолов
|
Номер соединения |
Спектры ЯМР 13С, δ, м.д. (CD3)2CO |
||||||
|
С4 |
С5 |
С6 |
СH3–N |
C = O |
CH3 |
CH2 |
|
|
3 |
136,4 |
137,9 |
115,4 |
43,4 |
158,5 |
13,4 |
67,5 |
|
4 |
135,5 |
131,0 |
116,0 |
37,9 |
158,9 |
14,2 |
67,6 |
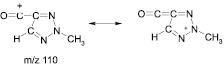
Пики молекулярных ионов в масс-спектре обоих соединений отсутствуют, но молекулярную массу можно легко установить по достаточно интенсивным пикам ионов с m/z 213. Пиков, соответствующих ионам [M–OC2H5]+, характерных для этиловых эфиров карбоновых кислот, в масс-спектрах не наблюдается. Дальнейшая фрагментация приводит в случае соединения (4) к иону с m/z 155 (это либо [M–NO2–NO–CO]+, либо [M–NO2–NO–C2H4]+), пик которого весьма интенсивен (67 %). В масс-спектре соединения (3) пик этого иона отсутствует, но вместо него имеется интенсивный (97 %) пик иона с m/z 110. Он образуется путем отрыва от иона [M–NO2]+ молекулы NO и этоксикарбонильной группы и также хорошо стабилизирован сопряжением карбокатионного центра с триазольным фрагментом:
В масс-спектрах обоих соединений присутствуют также интенсивные пики иона с m/z 30 (NO), характерные для нитросоединений. Положение метильной группы в триазольном цикле можно установить, сравнивая относительные интенсивности пиков ионов с m/z 42 и 43 в спектрах соединений (3, 4). В масс-спектре соединения (4) пик иона с m/z 43 имеет интенсивность всего 6,7 %, тогда как пик иона с m/z 42 максимален (100 %). Ион с m/z 42 образуется в результате фрагментации триазольного цикла. Наиболее вероятный его предшественник – ион [M–NO2]+, хотя не исключено образование иона с m/z 43 и из других ионов, например из иона с m/z 155.
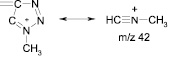
В масс-спектре соединения (3) пик иона с m/z 42 маловероятен (1,5 %), а интенсивность пика с m/z 43 составляет 27 %.
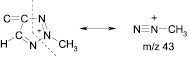
Таким образом, масс-спектры этих соединений весьма характеристичны и позволяют установить как молекулярную массу, так и положение метильной группы в триазольном цикле.
С целью создания в ряду азагетероциклических соединений новых соединений, обладающих гербицидной активностью, нами были получены калиевые и гидразиниевая соли 4-динитрометил-1,2,3-триазолов (5–7), что также дополнительно доказывает изомерную принадлежность триазолов. Алкилированные 4-динитроэтоксикарбометил-1,2,3-триазолы (3, 4) при действии на них гидроксида калия или гидразин-гидрата отщепляют сложноэфирную группу и превращаются в соответствующие соли 4-динитрометил-1,2,3-триазолов (5–7).
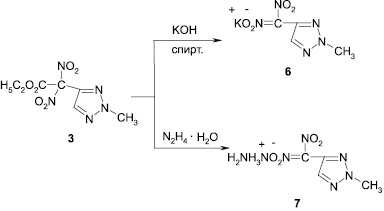
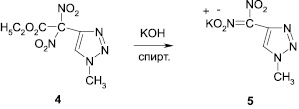
Таблица 4
Физико-химические характеристики солей 4-динитрометил-1,2,3-триазолов
|
Номер соединения |
Выход, % |
Тпл, °С (р-ль для перекрист.) |
УФ спектр, Н2О |
|
|
λmax, нм |
lg ε |
|||
|
5 |
80 |
182 (метанол) |
232 365 |
3,73 3,97 |
|
6 |
70 |
198 (метанол) |
232 365 |
3,76 3,93 |
|
7 |
79 |
142 (метанол) |
232 365 |
3,77 3,94 |
Физико-химические характеристики представлены в табл. 4.
С целью изучения гербицидной активности полученные соединения прошли скрининговые испытания в ФГУП «Центр по химии лекарственных средств». В результате испытаний установлено, что гидразиниевая соль (7) в концентрации 20 мг/л обладает высокой гербицидной активностью (% подавления – 100) по отношению к сорнякам ячменя, гороха и редиса. Гербицидная активность обеспечивается за счет присутствия в соединении (7) 1,2,3-триазольного кольца, являющегося антагонистом имидазольного цикла в триазольных аналогах аденина и гуанина. Выявлено, что наличие общей системы сопряжения 1,2,3-триазольного кольца с двойной связью, нитро, карбонильной или карбоксильной группами обеспечивает проявление более высокой гербицидной активности.
Выводы
Осуществлен синтез изомерных 4-динитроэтоксикарбометил-1,2,3-триазолов. Установлено, что среди синтезированных соединений преобладает изомер N2. Изучены реакции солеобразования замещенных 4-динитрометил-1,2,3-триазолов на примере их взаимодействия со спиртовым раствором гидроксида калия и гидразин-гидратом, которые привели к получению соответствующих солей. Выявлено наличие гербицидной активности у гидразиниевой соли 2-метил-4-динитрометил-1,2,3-триазола по отношению к сорнякам ячменя, редиса и гороха.
Работа выполнена при финансовой поддержке Фонда содействия развитию малых форм предприятий в научно-технической сфере (г. Москва) по программе «У.М.Н.И.К.» (договор № 7291 ГУ2/2015 от 03.08.2015 г.).



