Cинтез хелатных комплексов универсален, c его помощью можно получить множество координационных соединений с самыми разнообразными би- и полидентатными органическими лигандами. Темплатный синтез – это процесс комплексообразования, в котором ион металла с определенной стереохимией и электронным состоянием помимо своей основной функции (комплексообразователя) выступает еще и в качестве своеобразного лекала или шаблона для образования из соответствующих исходных веществ таких лигандов.
В качестве темплатов использовали ионы 3d-элементов (Cu (II), Ni (II), Co (II), Cd (II), Pb (II)). Характер связи зависит от природы комплексообразователя, его координационного числа, немаловажное значение также имеют электронные характеристики, в частности, эффективный заряд металла и способность отдавать d-электроны на р-орбиталь лиганда [1, 2, 5].
Неполное замещение координационной сферы Сu2+ приводит к образованию смешанно-лигандных комплексов с участием молекул воды, в случае использования аминофенола – NH2-групп.
При проведении синтеза гуминовые кислоты (ГК) выступают как макромолекула с наличием набора функциональных групп с собственным набором донорных атомов, которые ориентируются вблизи иона металла, после чего в реакцию вступают другие функциональные группы – м-аминофенола в качестве сшивающего агента формалин с получением макроциклического соединения.
Проведение такого темплатного синтеза позволяет получить аминометаллокомплексные структуры на основе гуминовых кислот, которые были использованы для создания настроенных на определенные ионы металла сорбентов, обладающих определенным размером пор, равным ионному радиусу и комплементарных структуре металла, содержащегося в комплексе на стадии синтеза.
Проведение такого темплатного синтеза образует металлокомплексные системы гуминовых кислот [2, 5].
Материалы и методы исследования
К навеске 10 г ГК, растворенных в ДМФА, добавляли раствор соли, содержащий 15 мг-экв/г металла (CuCl2, CoCl2, NiCl2 соответственно). После перемешивания добавляли 5 г м-АФ, растворенного в 50 мл раствора ДМФА. Полученный гель высушивали. Затем навеску 5 г металлокомплексного ионита заливали 50 мл 0,1 н раствора HCl и нагревали в течение 15 минут. Смесь фильтровали и промывали 50 мл 0,1 н раствора соляной кислоты, затем дистиллированной водой до исчезновения ионов хлора [4]. Таким образом, получали комплекситы, обладающие избирательной сорбцией по отношению к целевым металлам.
Для исследования селективной сорбции одного иона из смеси бинарных соединений после установления равновесия были отфильтрованы и промыты дистиллированной водой, затем количественно перенесены в колонки для селективного элюирования ионов (Cu2+, Co2+, Ni2+) в отдельности после их совместной сорбции.
Сорбированные на ионитах ионы селективно элюировали ацетатным буферным раствором с различными значениями рН. Ионы кобальта элюировали ацетатным буферным раствором с рН = 5,3, ионы никеля ацетатным буферным раствором с рН = 4,7. Ионы меди элюировали 0,1 н раствором соляной кислоты. Скорость элюирования составляла 0,5 мл/мин, собирали фракции по 5 мл.
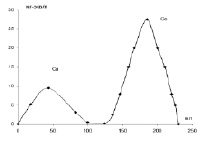
Рис. 1. Разделение ионов двухвалентных металлов на ионитах методом ступенчатого элюирования. Кобальт, элюент буферный раствор, рН = 5,3. Медь, элюент 0,1 н раствор HCl
Результаты исследования и их обсуждение
При промывании ионитов, извлеченных из бинарных смесей растворов солей, большая часть сорбированных металлов вымывается дистиллированной водой, лишь около 10 % остается на ионите. Для выделения прочно связанных ионов применяли ступенчатое элюирование буферными растворами в колонках. Полученные хроматограммы свидетельствуют о правильном выборе ацетатных буферных растворов с рН = 5,3 для кобальта и рН = 4,6 для никеля, т.к. в выбранных условиях полностью вымывается из сорбированных смесей ионов только один вид ионов, кобальта или никеля, а затем ионы меди элюируются 0,1 н раствором HCl.
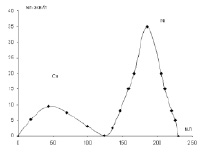
Рис. 2. Разделение ионов двухвалентных металлов на ионитах методом ступенчатого элюирования. Никель, элюент буферный раствор, рН = 4,7. Медь, элюент 0,1 н раствор HCl
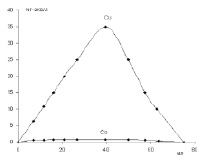
Рис. 3. Разделение ионов двухвалентных металлов на ионитах методом ступенчатого элюирования. Медь, элюент 0,1 н раствор HCl. Никель, элюент буферный раствор, рН = 4,7
Однако, проводя сорбцию из бинарных растворов, предполагали, что образуются иониты, ориентированные на определенный металл, но сорбировалось также незначительное количество нецелевого металла. Объяснить такое поведение можно, исходя из того, что синтезированные металлокомплексные иониты являются пространственными полимерами, содержащими функциональные группы как на периферии, так и внутри макромолекулы. В результате элюирования из металлокомплексного ионита ионы кобальта и никеля образуют при этом внутренние поры и будут иметь радиусы, равные атомным радиусам ионов кобальта (0,78 Å) или никеля (0,79 Å). Гидролизованные иониты помещали в бинарные растворы CuCl2 + СоCI2 и CuCI2 + NiCI2, а Cu2+, как более реакционноспособный металл, реагирует с периферийными функциональными группами, а внутренние ей не доступны, т.к. атомный радиус больше, чем у ионов кобальта и никеля, следовательно, и больше радиус пор. В результате с внутренними функциональными группами реагирует Co2+ в ионите Со или Ni2+ в ионите Ni [4].
При гидролизе металлокомплексный ионит Сu при сорбции ионов металлов из бинарной смеси солей, естественно, будет сорбировать только Cu2+, т.к. Cu2+ может реагировать как с концевыми, так и внутренними группами. Радиус пор в этом случае равен радиусу иона Cu2+ (0,80 Å).
Проведена обработка спектров ЯМР 13С исходных ГК, ионитов. Спектры ЯМР 13С ГК регистрировали в 5 мм ЯМР-ампуле на приборе Bruker Aspect 3000 при рабочей частоте 100 МГц. Ширина развертки спектра составляла около 26000 Гц, время регистрации сигнала спада свободной индукции (ССИ) 0,6 с, интервал между импульсами (Td) 8 с, при ширине импульса 90 °, длительность накопления спектра 72 часа. При регистрации был использован внешний стандарт MeOH/D2O (d = 49,0 м.д.). Навеску препарата 50–70 мг растворяли в 0,7 мл 0,3 М NaOD. Фурье-преобразование выполнялось с предварительным экспоненциальным взвешиванием сигнала ССИ с константой времени, эквивалентной уширению линий 35 Гц.
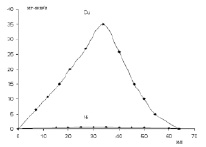
Рис. 4. Разделение ионов двухвалентных металлов на ионитах методом ступенчатого элюирования. Медь, элюент 0,1 н раствор HCl. Кобальт элюент буферный раствор, рН = 5,3
Распределение углерода по структурным фрагментам определяли интегрированием спектра ЯМР 13С (рис. 5) по шести спектральным областям, в которых находятся группы сигналов атомов углерода со сходным химическим окружением.
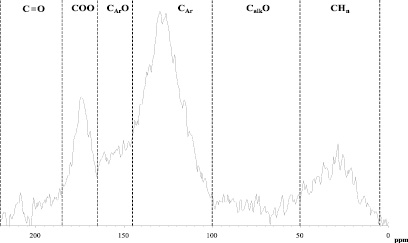
Рис. 5. Спектры ЯМР 13С препарата ГК (спектры регистрировали на Bruker Aspect 3000 на рабочей частоте 100 MHz при 303 К, время задержки между импульсами – 8 сек, 5 мм датчик, растворитель – 0,3 М NaOD, навеска препарата – 50–70 мг)
Отнесения проводили согласно [3]:
I. 0 – 48 м.д.: сигналы алифатических атомов углерода (CHn);
II. 48 – 100 м.д.: сигналы алифатических атомов углерода, связанных простой связью с гетероатомом (кислородом или азотом), в основном, принадлежащие фрагментам карбогидратов (CalkO);
III. 100 – 145 м.д.: сигналы С- и Н- замещенных ароматических атомов углерода (Car);
IV. 145 – 167 м.д.: сигналы О-замещенных ароматических атомов углерода (CarO);
V. 167 – 185 м.д.: сигналы атомов углерода карбоксильных, сложноэфирных и амидных групп (COO);
VI. 185 – 220 м.д.: сигналы атомов углерода кетонных и хинонных групп (C=O).



